Трансплантация печени
В данной статье речь пойдёт о трансплантации печени: правовые аспекты трансплантации печени в РФ, показания к операции, подготовка к оперативному лечению, виды доноров, оперативное вмешательство у пациентов, особенности ведения реципиентов после операции.
Каждому человеку нужна здоровая печень для осуществления нормальной жизнедеятельности. Печень выполняет ряд жизненно важных функций в организме: она обеспечивает синтез глюкозы, белков, жиров, витаминов, выработку желчных кислот и холестирина, она отвечает за образования ряда факторов свёртывающей и противосвёртывающей систем организма. Также печень служит своего рода «фильтром» — она обеспечивает обезвреживание различных чужеродных веществ, в том числе аллергенов и токсинов. Если хотя бы одна из этих функций будет серьёзно нарушена, это может стать жизнеугрожающей ситуацией для организма.
Симптомы и синдромы заболевания печени:
Содержание статьи:
- Желтуха — пожелтение кожи, и видимых слизистых оболочек;
- Потемнение мочи (цвет тёмного чая или тёмного пива);
- Обесцвечивание кала;
- Желудочно-кишечные кровотечения (рвота кровью, рвота чёрными массами, чёрный стул или кровь в стуле);
- Зуд;
- Асцит — скопление жидкости в животе;
- Склонность к кровоточивости слизистых носа, дёсен и т.д.;
- Энцефалопатия — нарушения памяти, забывчивость, спутанность сознания и подобные неврологические нарушения.
Помимо всего прочего, печеночная недостаточность даёт осложнения на другие органы и системы, что в итоге может привести к нарушению работы почек, лёгких, что в комплексе очень сильно ухудшает тяжесть состояния пациентов и требует дополнительного более сложного лечения.
При развитии печеночной недостаточности в исходе различных заболеваний, часто единственным методом лечения становится трансплантация печени.
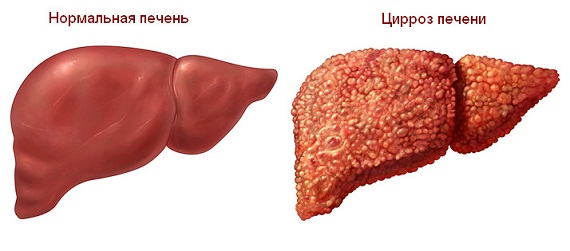
Кто нуждается в трансплантации печени?
Трансплантация печени является наиболее эффективным и, часто, единственным радикальным методом лечения больных с терминальной стадией хронических диффузных болезней печени (цирроз, фиброз и пр.), фульминантной печеночной недостаточностью, злокачественными и доброкачественными опухолями печени.
В трансплантации печени нуждаются пациенты со следующими заболеваниями:
- Цирроз печени в исходе вирусных гепатитов B, C и D;
- Аутоиммунный гепатит;
- Токсический гепатит;
- Криптогенный цирроз печени (цирроз печени неуточнённой этиологии);
- Билиарный цирроз печени;
- Первичный склерозирующий холангит (ПСХ);
- Болезнь Кароли;
- Алкогольный цирроз печени (цирроз Лаэннека) — при условии 6-месячной алкогольной ремиссии;
- Острая печеночная недостаточность;
- Опухоли печени;
- Нейроэндокринные опухоли;
- Гепатоцеллюлярная карцинома (ГЦК);
- Гемангиоэндотелиома;
- Метастазы гастроинтестинальной стромальной опухоли (при условии медленного роста);
- Цирроз печени в исходе дефицита альфа-1-антитрипсина;
- Муковисцидоз; (статья по теме — трансплантация печени при муковисцидозе);
- Семейная гиперхолестеринемия;
- Гемохроматоз;
- Болезнь Вильсона-Коновалова;
- Болезни накопления гликогена
- Синдром Бадда-Киари;
- Синдром Клиглера-Найяра;
- Поликистоз печени;
- Синдром Алажиля;
- Амилоидоз;
- Саркоидоз;
- Обширная травма печени, ведущая к печеночной недостаточности.
Противопоказания к трансплантации печени.
После того как были исчерпаны возможности консервативного лечения и установлена необходимость трансплантации печени требуется ответить на 3 основных вопроса:
- Сможет ли пациент перенести операцию и ранний послеоперационный период;
- Будет ли пациент привержен к терапии и режиму необходимому для выживания после трансплантации печени;
- Есть ли у пациента сопутствующие заболевания, которые могут скомпрометировать его выживание или функцию трансплантата.
Абсолютные противопоказания:
- СПИД;
- внепечёночное распространение злокачественных опухолей;
- активная внепеченочная инфекция (туберкулез и другие);
- активный алкоголизм и наркомания;
- психические заболевания, исключающие регулярный прием иммунодепрессантов;
Относительные противопоказания:
- высокий кардиологический или анестезиологический риск;
- распространенный тромбоз воротной вены (статья по теме — трансплантация печени у пациентов с тромбозом воротной вены);
- ранее перенесенные вмешательства на печени;
- возраст более 60 лет;
- индекс массы тела (ИМТ) более 35 кг/м2.
Также читайте статью: Пересадка печени ребенку: о листе ожидания, донорах и операции.
Виды органного донорства.
В качестве потенциальных доноров рассматриваются как посмертные доноры, так и живые родственные доноры.
Трансплантация печени от посмертного донора.
Печень для трансплантации изымается только у посмертных доноров, перенесших смерть головного мозга (с сохранённым кровообращением и поддерживаемым аппаратным дыханием). Обстоятельства смерти и личности умерших доноров остаются конфиденциальными. Изъятие органов и (или) тканей не допускается, если установлено, что они принадлежат лицу, страдающему болезнью, представляющей опасность для жизни и здоровья реципиента. Подробнее здесь и здесь. Выполняют ортотопическую трансплантацию печени (целого органа), так и SPLIT-трансплантацию (донорская печени разделяется на две части и каждая часть пересаживается отдельному реципиенту).
Статья по теме: https://doctorsemash.com/tx-law-russia/
Трансплантация печени от живого донора.
В Российской Федерации, как и во многих других странах, в целях трансплантации печени широко распространено использование фрагментов печени взрослых доноров. Этот вид трансплантологической помощи обладает рядом преимуществ – хорошее качество трансплантата, возможность проведения операции в необходимые сроки, и как правило, тканевая совместимость с донором. Такой вид трансплантации в нашей стране наиболее часто выполняют детям (трансплантация левого латерального сектора печени, трансплантация правой или левой доли печени).
Правовые аспекты родственного органного донорства в РФ.
По законам Российской Федерации, трансплантация печени (как и почки) от живого донора может быть произведена только в том случае, если потенциальный донор является биологическим родственником реципиента. Это могут быть ближайшие родственники — мать или отец, а так же более отдалённые — тётки, дяди, сёстры и братья. Стоит отметить, что супруги не являются кровными родственниками. Также, если реципиент является усыновлённым ребенком, его усыновители не могут быть донорами для него, в отличие от его биологических родителей. К донорству нельзя принуждать. Изъятие органов и (или) тканей не допускается, если установлено, что они принадлежат лицу, страдающему болезнью, представляющей опасность для жизни и здоровья реципиента. Изъятие органов и (или) тканей для трансплантации у лиц, находящихся в служебной или иной зависимости от реципиента, не допускается. Подробнее здесь и здесь.
Статья по теме: https://doctorsemash.com/tx-law-russia/
Обследование живого родственного донора.
В качестве живого родственного донора обследуется кровный родственник реципиента старше 18 лет. В первоначальной беседе врач выявляет первичные противопоказания к донорству — проводит сбор анамнеза (выясняет у пациента подробно о перенесенных заболеваниях, наличии аллергических реакций, проводит измерение роста и веса, проводит психоэмоциональную оценку потенциального донора).
Далее проводится комплекс лабораторно-диагностического обследования, который включает в себя:
- Определение группы крови и резус-фактора;
- Клинический анализ крови с подсчётом лейкоцитарной формулы;
- Общий анализ мочи;
- Биохимический анализ крови;
- КЩС и электролитный статус;
- HLA-типирование и перекрестная лимфоцитотоксическая проба;
- Обзорная рентгенография органов грудной клетки;
- Электрокардиография;
- УЗИ сердца (ЭХО-КГ);
- Эзофагогастродуоденоскопия;
- Исследование функции внешнего дыхания (по показаниям);
- Ультразвуковая допплерография нижних конечностей.
Также, особенно важным аспектом обследования родственного донора является дооперационная оценка печени. Для этого выполняются УЗИ органов брюшной полости, мультиспиральная компьютерная томография органов брюшной полости с внутривенным болюсным контрастированием. При индексе массы тела потенциального донора печени боле 25,0 баллов, выполняется пункционная биопсия печени.
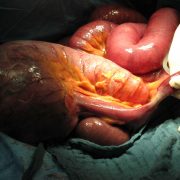
Трансплантация печени (оперативное лечение).
Собственно оперативное вмешательства начинается с двухстороннего субкостального разреза, дополненного срединным разрезом до мечевидного отростка. При выполнении доступа требуется соблюдение тщательного гемостаза, ввиду наличия обширной развитой сети подкожных вен. Хирургическое вмешательство у реципиента включает в себя следующие этапы:
- Гепатэктомия;
- Наложение сосудистых анастомозов (в следующей последовательности – кавальная, портальная, артериальная реконструкция);
- Гемостаз и формирование желчеотводящего анастомоза.
Удаление пораженной печени в большинстве случаев представляет собой наиболее трудоемкий этап. В случае опухолевых поражений печени это связано с выраженной гепатомегалией. В случаях же цирроза, несмотря на значительное уменьшение размеров печени, гепатэктомия усложняется наличием венозных коллатералей в связках печени и ее воротах, наличием спаек, а также изменением обычных топографо-анатомических отношений в верхнем отделе брюшной полости и, нарушениями свертывающей системы крови.
Рассечение связочного аппарата начинают с круглой и серповидной связок. Затем пересекаются левая треугольная и левая венечная связки. Следующей составляющей этапа гепатэктомии является диссекция печеночно- двенадцатиперстной связки, при этом выделение воротной вены и печеночной артерии предусматривает полное освобождение от околососудистой ткани, тогда как при выделении желчного протока скелетирование последнего нежелательно.
Доступ к элементам печеночно-двеннадцатиперстной связки может быть крайне сложен. Изоляции элементов могут мешать увеличенные лимфатические узлы, содержащие множественные венозные и лимфатические коллатерали, спайки после перенесенных оперативных вмешательств. Общий желчный проток с окружающей клетчаткой пересекается. Собственная печеночная артерия выделяется до паренхимы. Она или ее долевые ветви должны быть лигированы как можно дистальнее. Проксимально артерия мобилизуется до желудочно- двеннадцатиперстной с выделением последней и взятием на держалку. Воротная вена склелетируется с подведением турникета.
После мобилизации элементов печеночно-двеннадцатиперстной связки рассекают правую венечную связку и мобилизуют правую долю печени. Данная манипуляция в условиях выраженного фиброза, развития венозных коллатералей, в особенности при уменьшении размеров печени представляет значительные трудности и нередко осложняется диффузным кровотечением из паренхимы печени. После описанных манипуляций становится доступной позадипеченочный отдел НПВ.
Дальнейшие действия зависят от избранной техники имплантации печени «классической» или Piggyback.
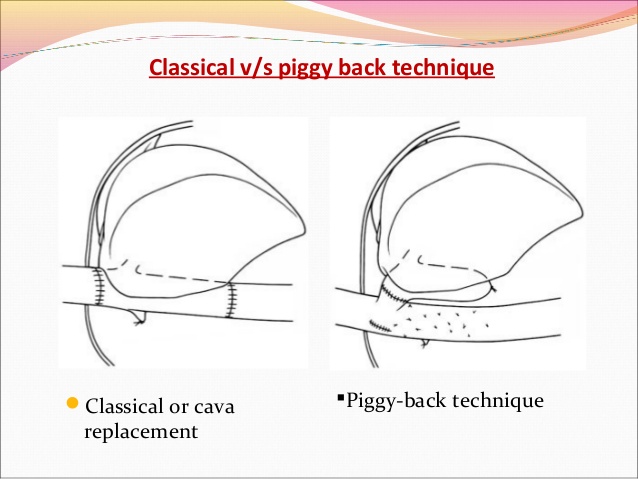
Техника классической трансплантации печени и техника Piggy-back.
Классическая техника ортотопической трансплантации печени.
Позадипеченочный отдел нижней полой вены мобилизуется на всем протяжении ретрокавального пространства: от почечный вен до диафрагмы. Ключевым моментом является выделение и пересечение правой надпочечниковой вены, впадающей непосредственно в нижнюю полую вену. После подготовки нижней полой вены пережимается воротная и полая вены (проксимально и дистально), выполняется гепатэктомия. Формируются анастомозы нижней полой вены донорской печени и реципиента проксимально и дистально и анастомоз воротной вены. Для поддержания гемодинамики традиционно использовалось обходное вено-венозное шунтирование. Для этого до гепатэктомии канюлируется воротная вена, предварительно подготовленные левая бедренная и подмышечная вены. Кровь от нижней половины тела и органов брюшной полости с помощью насоса направляется в верхнюю полую вену. Обходное вено-венозное шунтирование может применяться на начальных этапах освоения трансплантации печени.
Техника Piggyback.
Данный вариант подразумевает сохранение кровотока по нижней полой вене, отделение печени от позадипеченочного отдела НПВ. Пересечение связки НПВ по является ключевым моментом мобилизации позадипеченочного отдела НПВ, особенно в той ситуации, когда гипертрофированная хвостатая доля (I сегмент) окружает НПВ. Все мелкие печеночные вены, дренирующие хвостатую долю, и добавочные правые печеночные вены раздельно лигируются и пересекаются по направлению снизу вверх до уровня основных печеночных вен Таким образом, нижняя полая вена реципиента сохраняется на всем протяжении. Производится пережатие печеночных вен и воротной вены. Выполняется гепатэктомия без пережатия нижней полой вены. Устья печеночных вен объединяются, формируется анастомоз с надпеченочным отделом НПВ донорской печени. Подпеченочный отдел НПВ трансплантата ушивается. В некоторых случаях правая печеночная вена расположена каудально, что делает невозможным вовлечение ее в шов. В этом случае последнюю обходят циркулярно и пересекают между двумя зажимами, затем ушивают стороны НПВ непрерывным швом нитью / . В то же время пересечение правой печеночной вены позволяет отвести печень влево и провести безопасную изоляцию средней и левой печеночных вен.
Методика Piggyback c формированием анастомоза по типу «бок в бок».
Вариантом методики Piggyback, предложенным Belghiti является формирование анастомоза по типу «бок в бок» между ретропеченочным отделом НПВ реципиента и трансплантата. Производят предварительную подготовку НПВ трансплантата: ушиваются проксимальный и дистальный отдел полой вены донорской печени. После продольного частично пережатия полой вены реципиента максимально широко рассекается ее передняя стенка. Соответственно этому рассекается задняя стенка НПВ трансплантата, выполняется формирование анастомоза. В течение кавальной реконструкции трансплантат перфузируется мл или 1 раствора альбумина. Приступают к анастомозу воротной вены, которая предварительно максимально укорачивается. После окончания портального анастомоза снимаются зажимы с нижней полой и воротной вен, начинается реперфузия трансплантата. Кровотечение по линии анастомозов останавливается дополнительными швами. Артериальный анастомоз может быть выполнен в различных вариантах, в зависимости от состояния сосудов донора и реципиента, а также предпочтений хирурга. Наиболее часто артерия трансплантата на уровне чревного ствола анастомозируется с артерией реципиента на уровне гастродуоденальной артерии. В некоторых случаях использование артерии реципиента для анастомоза не представляется возможным (малый диаметр, доминирующая правая печеночная артерия из системы верхней брыжеечной артерии, изменения стенки сосуда после эндоваскулярных вмешательств). В этом случае может быть использована селезеночная артерия трансплантата. Альтернативным вариантом является использование подвздошных сосудов донора или сосудистого протеза и анастомоз с инфраренальным отделом аорты. Имплантация печени завершается билиарной реконструкцией. Наиболее предпочтительна холедохо-холедохостомия без дренирования. При невозможности использования собственного протока следует выполнить холедохоеюностомию. Операция завершается тщательным гемостазом и дренированием брюшной полости.
Хирургическая техника родственной ортотопической трансплантации левого латерального сектора печени.
Донорский этап.
Донору выполняется левосторонняя латеральная секторэктомия. На основании принципов хирургии живых родственных доноров и необходимости получить жизнеспособный трансплантат с приемлемым анатомическим вариантом кровоснабжения и желчеоттока, основными задачами при операции у донора являются:
- минимизация кровопотери при сохранённом кровоснабжении печени в период разделения паренхимы;
- сокращение времени тепловой ишемии трансплантата;
- получение пригодных для последующей реконструкции участков сосудов (левой печ ночной вены, левой ветви воротной вены и левой печёночной артерии).
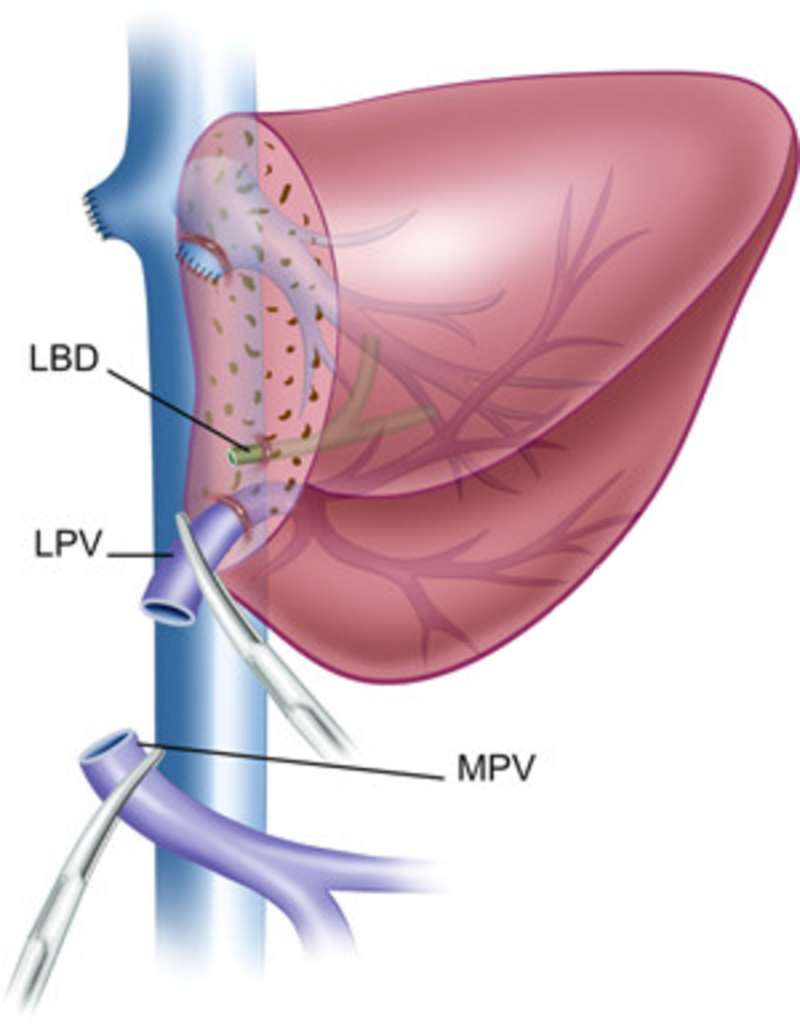
Левый латеральный сектор печени.
Реципиентский этап.
Операция у детей раннего возраста имеет ряд особенностей ввиду маленьких размеров брюшной полости ребёнка и проявлений основной болезни: гепатомегалии, спленомегалии, а также портальной гипертензии. Факторами, осложняющими операцию, могут быть последствия перенесённого ранее оперативного вмешательства. После пересечения связочного аппарата печени, мобилизации над-, подпечёночных и ретропечёночного отделов нижней полой вены и диссекции на протяжении элементов печёночно-двенадцатиперстной связки приступают к собственно гепатэктомии, которая включает:
- лигирование и пересечение долевых печёночных артерий;
- пережатие воротной вены сосудистым зажимом над областью слияния верхней брыжеечной и селезёночной вен;
- пережатие подпечёночного (над устьями почечных вен), затем надпечёночного отделов нижней полой вены;
- отсечение печени острым путём по паренхиме над нижней полой веной с оставлением на ней небольшого фрагмента;
- продольное рассечение остатка печени над нижней полой веной;
- прецизионное лигирование, клипирование и пересечение коротких вен, дренирующих преимущественно I сегмент и следующих к нижней полой вене от правой доли печени.
Методика имплантации левого латерального сектора печени После скелетизации и проверки герметичности нижней полой вены приступают к наложению сосудистых анастомозов. При наложении гепатико-кавального анастомоза необходимо создание широкого соустья путём объединения устий печёночных вен реципиента с последующим рассечением нижней полой вены в нисходящем направлении, таким образом создается треугольный дефект последней высотой 2,5-3 см, адекватный сформированному устью левой печ ночной вены трансплантата. Анастомоз накладывается непрерывным швом нитью PDS 5/0 или 4/0. Следующим накладывается порто-портальный анастомоз непрерывным швом нитью PDS 6/0. Завершение портальной реваскуляризации позволяет осуществить реперфузию трансплантата путём поочерёдного снятия зажимов:
- с надпечёночного отдела нижней полой вены;
- с воротной вены;
- с подпечёночного отдела нижней полой вены.
После выполнения гемостаза, следующего за реперфузией, в основном заключающегося в коррекции герметичности гепатикокавального анастомоза и дефектов стенки нижней полой вены, приступают к артериальной реконструкции. Принимается решение о выборе уровня печ ночной артерии реципиента для анастомозирования с левой долевой печёночной артерией трансплантата. Анастомоз накладывается атравматической нерассасывающейся нитью Prolene 7/0. Для увеличения просвета анастомозируемых сосудов прибегают к продольному рассечению соответствующих стенок артерий трансплантата и реципиента. Сосудистые анастомозы необходимо формировать при оптическом 3-х кратном увеличении операционного поля.
Билиарную реконструкцию выполняют путем наложения гепатикоеюноанастомоза с выключенной по Ру петлей тощей кишки. Диаметр протока трансплантата может быть увеличен за счет продольного рассечения его стенки. Дренирование желчных путей при выполнении билиарной реконструкции нецелесообразно. Операция завершается тщательным гемостазом и дренированием брюшной полости.
Послеоперационное ведение пациентов после трансплантации печени.
В раннем послеоперационном периоде пациентам проводится мониторинг, который включает в себя:
- ЭКГ – ежечасно, запись на ленту – 1 р/сут с последующим описанием в отделении функциональной диагностики;
- Пульсоксиметрия – постоянно;
- Частота дыхания – постоянно;
- Диурез – катетер Фолея со стерильным мочеприемником для измерения почасового диуреза;
- Контроль отделяемого из дренажей, учет отделяемого по каждому дренажу в отдельности;
- Учет отделяемого по назогастральному зонду;
- Температура тела – постоянно.
Помимо этого, оцениваются следующие данные:
- Контроль показателей газового и электролитного состава крови, кислотно- щелочного равновесия каждые 3 часа;
- Контроль показателей тканевого метаболизма каждые 3 часа: уровень лактата, содержание глюкозы в плазме крови;
- Общий анализ крови (подсчет форменных элементов крови, уровень гемоглобина, гематокрита) один раз в сутки в течение 1 дней, далее при благоприятном течении послеоперационного периода 2 раза в неделю;
- Биохимическое исследование крови (билирубин (общий прямой), АСТ, АЛТ, ЛДГ, ГГТ, ЩФ, мочевина, креатинин, холестерин) один раз в сутки в течение 7 дней, затем два раза в неделю;
- Показатели коагулограммы (время свертывания крови, протромбиновый индекс, МНО, агрегационная способность тромбоцитов, фибриноген, антитромбин III, протеин С) один раз в сутки в течение 7 дней, затем два раза в неделю;
- Контроль титров группоспецифических антител, проводится в течение первой недели после трансплантации – ежедневно, далее 1 раз в 1-2 дня.С 3-й недели после операции, при условии гладкого течения послеоперационного периода, определение титров антигрупповых антител проводится дважды в неделю. С 4-й недели после операции и до выписки пациентов, перенесших трансплантацию от АВО-несовместимого донора, из стационара достаточным можно считать определение группоспецифических антител 1 раз в неделю (при отсутствии эпизодов их повышения);
- Ежедневные микробиологические исследования крови в течение 7 суток, затем в течение 7 суток 2 раза в неделю;
- Определение концентрации иммуносупрессивных препаратов. В течение 14 суток – ежедневно, далее — не менее 2 раза в неделю;
- УЗИ — ежедневно 1-2р/сут в течение 14 суток;
- Рентгенография органов грудной клетки 1-2 раза в неделю первые 2-3 недели;
- КТ по показаниям
Пациентам проводится антибактериальная, противогрибковая, противовирусная, иммуносупрессивная, гастропротективная, спазмолитическая, инфузионно-трансфузионная терапия, которая подбирается индивидуально.
Иммуносупрессивная терапия, как правило, назначается пожизненно.
После выписки из стационара, пациент должен регулярно наблюдаться амбулаторно.


Супер статья!
Очень полезная статья, мне очень помогла, спасибо!
Очень все подробно.Спасибо.Готовлюсь стать донором