Первичный билиарный холангит: клинические рекомендации EASL
Первичный билиарный холангит: клинические рекомендации EASL. В данной статье представлены последние клинические рекомендации по диагностике и тактике лечения первичного билиарного холангита.
Введение
Содержание статьи:
Первичный билиарный холангит (ПБХ), ранее известный как первичный билиарный цирроз, — редкое заболевание, поражающее преимущественно женщин, знать которое клиницисту-практику важно. Для этого повсеместно встречающегося аутоиммунного холестатического заболевания печени характерны холестаз, наличие в сыворотке антимитохондриальных (АМА) или специфических антинуклеарных антител (АНА) и гистологическая картина хронического негнойного гранулематозного лимфоцитарного воспаления мелких желчных протоков.
ПБХ имеет хроническое течение и часто прогрессирует до терминальной стадии цирроза печени со свойственными ему осложнениями. Наиболее молодой возраст, в котором он описан, — 15 лет (у девушки в постменархе).У детей случаи с классической клинической картиной неизвестны. Цель пожизненной терапии — предотвращение прогрессирующего поражения печени и облегчение симптомов, ухудшающих качество жизни больных.
Причины развития ПБХ.
Что приводит к развитию ПБХ, точно не установлено. По-видимому, значительную роль играют средовые факторы, запускающие, при наличии иммуно- и эпигенетических факторов риска, хроническое иммуноопосредованное повреждение эпителия желчных протоков с последующим холестазом, дуктопенией и прогрессирующим билиарным фиброзом. По многочисленным опубликованным данным, в мире 1 из каждой 1000 женщин старше 40 лет страдает ПБХ.
Продолжающиеся эпидемиологические исследования помогают лучше уяснить бремя ПБХ в мире в целом и в европейских странах. Заболеваемость им составляет приблизительно 1–2 случая на 100 000 населения в год. По разным данным, заболеваемость колеблется в пределах 0,3–5,8, распространенность — 1,9–40,2 на 100 000. Болеют ПБХ преимущественно женщины (что подтверждается данными крупных регистров, но не нашло объяснения, хотя в последнее время доля мужчин среди больных увеличивается.
Понимание патогенеза ПБХ важно для оказания эффективнойпомощи, расширения ее возможностейисоздания более целенаправленных методов терапии. В основе прогрессирующего поражения лежит взаимодействие иммунных и желчных механизмов и холестаза, запускающее взаимозависимые постоянные процессы холестаза и фиброза печени (рис. 1). Экспериментальные исследования, в которых удалось воспроизвести значимые иммунологические характеристики ПБХ, указали на важность сигнального пути интерферона (IFN) в его патогенезе. Решающую роль в утрате иммунологической толерантности к эпителию желчных протоков играет воспалительный ответ, опосредованный T-хелперами 1-го типа (об этом отчасти свидетельствует связь ПБХ с АМА). Отсюда понятно значение в его патогенезе генетических факторов риска, касающихся основных иммунорегуляторных путей, в т. ч. интерлейкина (IL)-12 и JAK-STAT (Янус-киназного пути передачи сигнала и активации транскрипции), и локусов человеческого лейкоцитарного антигена (HLA). Иммунологическое повреждение поддерживается холестатическим. Поскольку от инвазии гидрофобных мономеров желчных кислот эпителий защищает обменник Cl/HCO3 – (AE2) и неповрежденный гликокаликс, снижение образования AE2 при ПБХ предрасполагает холангиоциты к апоптотическому повреждению за счет активации аденилатциклазы. Кроме того, гидрофобные желчные кислоты, в частности гликохенодезоксихолевая, подавляют экспрессию AE2 холангиоцитами вследствие образования свободных окислительных радикалов и старения клеток, что приводит к воспалению желчных протоков.
Холестаз при ПБХ сопровождается провоспалительными сдвигами:
- снижением образования AE2, SLC9A3 (обменника Na/H+) и инозитол-1,4,5-трифосфатных рецепторов;
- уменьшением концентрации бикарбоната в желчи;
- снижением активности ее щелочной фосфатазы (ЩФ).
Понимание этиологии повреждения печени при ПБХ углубилось благодаря достижениям исследований оси кишечник–печень, в т. ч. сигнального пути фарнезоидного рецептора X (FXR) и фактора роста фибробластов (FGF)-19. FXR — центральный транскрипционный сенсор метаболизма желчных кислот. Одним из важнейших для его сигнального пути генов в кишечнике является FGF-19, кодирующий энтерокин, поступление которого в портальный кровоток сопровождается связыванием желчных кислот FXR. ПБХ прогрессирует до терминальной стадии цирроза печени, при которой единственным средством спасти жизнь больного становится трансплантация печени (ТП), и сопровождаетсямножествомтягостных симптомов (зудом, сухостью слизистых, неприятными ощущениями в животе, утомляемостью), часто — синдромом «беспокойных ног», бессонницей, депрессией и когнитивной дисфункцией. Расширение познаний относительно ПБХ привело к разграничению уровней риска при немна высокий и низкий по ответу на терапию препаратом первой линии — урсодезоксихолевой кислотой (УДХК). Для идентификации наибольшего риска тяжелых осложнений значимы возраст начала и длительность заболевания, пол и динамика ряда биохимических и серологических показателей до и на фоне УДХК-терапии.
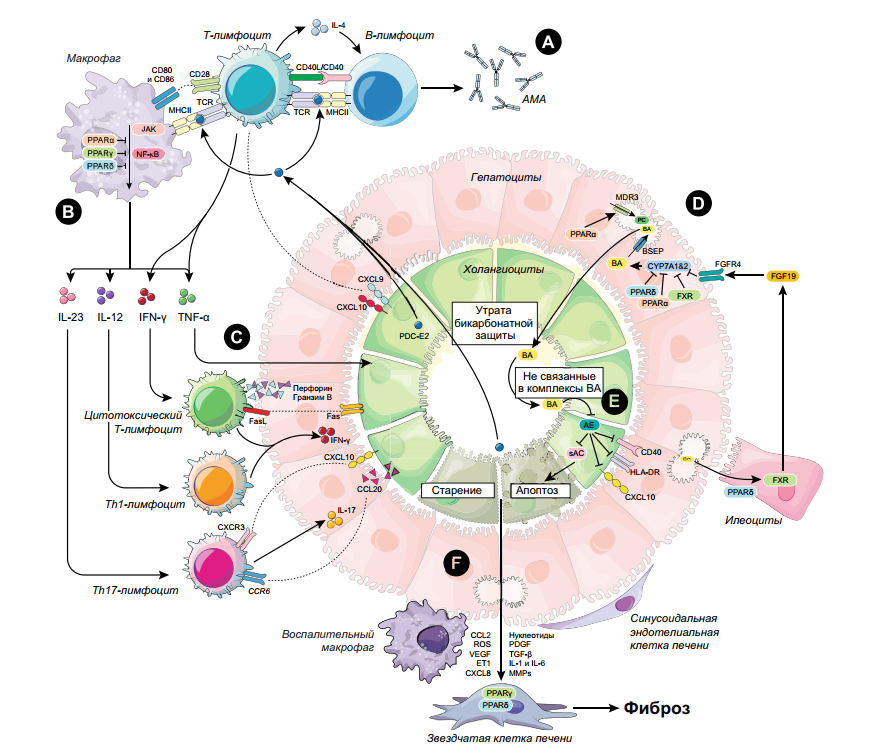
(A) образование антимитохондриальных антител против PDC-E2 за счет взаимодействия T- и B-лимфоцитов; активация B-лимфоцитов костимулирующими молекулами, в т. ч. CD40/CD40L;
(B) активация иммунных клеток (в т. ч. макрофагов), частично опосредованная сигнальными путями JAK-STAT и NFκB; связывание PPAR, уменьшающее активацию NFκB;
(C) образование цитокинов, в т. ч. IFN-γ (стимулирующего цитокиновую активность T-лимфоцитов), TNF-α (индуцирующего апоптоз и старение BEC) и IL-4 (стимулирующего активность B-лимфоцитов и выработку антител) активированными T-лимфоцитами (первоначально ориентированными взаимодействием CXCL9 иCXCL10). По мере прогрессирования заболевания преобладание в воспалительных инфильтратах цитотоксических лимфоцитов и Th1 сменяется увеличением количества Th17-позитивных клеток. Цитотоксические T-лимфоциты индуцируют апоптоз и клеточное старение посредством взаимодействия FasL-Fas и секреции перфорина и гранзима B; цитотоксические T-лимфоциты и Th1 вырабатывают IFN-γ, стимулирующий апоптоз или старение; IL-17-секретирующие клетки Th17 появляются позже, привлеченные взаимодействием CXCR3-CXCL10 и CCR6-CCL20.
(D) Ферменты типа CYP7A1 и 2 превращают холестерин в BA, которые затем выводятся экспортирующими желчные соли помпами. FXR или FGF-19 уменьшают образование BA посредством связывания рецепторов FGFR4, PPARα/δ. В норме BA образуют комплексы с фосфатидилхолином и выводятся посредством MDR3.
(E) При ПБХ вследствие нарушения активности апикальной AE2 и секреции бикарбоната не связанные в комплексы BA действуют на мембраны BEC непосредственно. BEC становятся чувствительными к способствующему старению и проапоптотическому действию BA; не связанные в комплексы BA еще более подавляют активность AE. Дальнейшее ослабление бикарбонатной защиты вызывает экспрессию молекул, способствующих иммунному ответу (CD40, HLA-DR и CXCL10) и апоптозу (посредством растворимой аденилатциклазы).
(F) В процессе старения и апоптоза клетки секретируют медиаторы активации звездчатых клеток печени, поддерживающие воспаление, стимулирующие фиброз и нарастание холестаза (тогда как связывание PPARγ и PPARδ уменьшает эту активацию). В фиброгенезе участвуют также синусоидальные эндотелиальные клетки печени, провоспалительные макрофаги и клетки других типов. Гибель BEC приводит к дальнейшему выбросу PDC-E2. AE — анионный обменник; BA — желчные кислоты; BEC — клетки эпителия желчных протоков; BSEP — помпа, экспортирующая соли желчных кислот; CCL — лиганд хемокина CC; CXCL — лиганд хемокина (мотива C-X-C); CYP7A1&2 — холестерин 7-α-гидролаз A1 и A2; ET1 — эндотелин 1; Fas/FasL — лиганд CD95/CD95; HLA-DR — человеческий лейкоцитарный антиген; JAK — Янус-киназа; MDR3 — белок множественной лекарственной устойчивости 3; MHC II — II класс главного комплекса гистосовместимости; MMP — матриксная металлопротеиназа; NFκB — ядерный фактор — усилитель легкой κ-цепи активированных B-лимфоцитов; PC — фосфатидилхолины; PDC-E2 — субъединица E2 пируватдегидрогеназного комплекса; PDGF — фактор роста тромбоцитов; PPARα/γ/δ — активируемые пероксисомным пролифератором рецепторы α, γ или δ; ROS — активные окислительные радикалы; sAC — растворимая аденилатциклаза; TCR — T-клеточный рецептор; TGF-β — трансформирующий фактор роста β; Th — T-хелпер; TNF-α — фактор некроза опухолей α; VEGF — эндотелиальный фактор роста сосудов.»
По данным современного анализа международных регистров, 10-летняя выживаемость у получавших УДХК больных близка к 80 %. Однако важно понять, насколько терапия влияет на уровень риска. По данным прежних популяционных исследований в Великобритании, средняя выживаемость с момента появления симптомов составляла приблизительно 9–10 лет. Примерно у 25 % больных за этот срок развивалась печеночная недостаточность. Йельское исследование, показавшее более высокую, достигавшую 16 лет в «бессимптомных» случаях, медианную выживаемость, свидетельствует о неоднородности уровня риска. В отсутствие эффективной терапии медианный срок развития обширного фиброза печени составлял приблизительно 2 года, но у 1 /3 больных на протяжении 4 лет наблюдения сохранялась ранняя стадия заболевания. В то же время, по данным некоторых проспективных исследований, за 6 лет цирроз развился у каждого 2 больного, получавшего пеницилламин или плацебо, тогда как у получавших УДХК это происходило только в 1 из 10 случаев. В заключение следует еще раз подчеркнуть необходимость структурированной и индивидуализированной тактики пожизненной терапии ПБХ.
Настоящие рекомендации очерчивают концептуальные рамки, облегчающие практическим врачам диагностику и выбор эффективной тактики ведения ПБХ.
Процесс разработки рекомендаций.
Группа клиницистов, компетентных в области заболеваний печени и ПБХ, состав которой был одобрен руководящим советом Европейской ассоциации по изучению печени (EASL), разрабатывала и обсуждала настоящие рекомендации с ноября 2016 г. по март 2017 г. Рекомендации подверглись рецензированию экспертами того же уровня. Все участники до начала разработки рекомендаций предо- ставили информацию относительно конфликтов интересов согласно официально принятой EASL форме. Комитет по этике EASL на основании предоставленной информации рассмотрел состав группы разработчиков на предмет возможных (реальных или кажущихся) искажений. В раз- работке рекомендаций участвовали представители RARELIVER European Reference Network (ERN; Европейская справочная сеть по редким заболеваниям печени).
Уровень доказательности данных и обоснованности рекомендаций.
Для разработки рекомендаций проводился поиск данных, включенных в базы PubMed и Cochrane до 1 марта 2017 г. По возможности указан уровень доказательности данных и обоснованности рекомендаций (табл. 1) согласно системе их оценки GRADE. Обоснованность рекомендаций отражает уровень доказательности данных, на которые они опираются. Система GRADE предлагает две категории: четко и слабо обоснованные рекомендации (см. табл. 1). Уровень доказательности данных оценивается согласно трем категориям: высокий, дающий возможность четко обосновать рекомендацию, промежуточный, с колебаниями оценок и предпочтений, и неопределенный. Рекомендации, опирающиеся на данные неопределенного уровня доказательности, расцениваются как слабо обоснованные. Рекомендации по вопросам, относительно которых четких данных нет, опираются на согласованные экспертные мнения из литературных источников, соответствующие мнениям авторов настоящего документа. Интерпретировать рекомендации следует с учетом клинического контекста.
Таблица 1. Уровень доказательности данных и обоснованности рекомендаций (заимствование из системы GRADE).
| Уровень доказательности данных | |
| I | Рандомизированные контролируемые исследования |
| II-1 | Контролируемые исследования без рандомизации |
| II-2 | Когортные исследования и исследования «случай-контроль» |
| II-3 | Многочисленные серии наблюдений, неконтролируемые исследования с очень наглядными результатами |
| III | Мнения авторитетных экспертов, описательная эпидемиология |
| Уровень обоснованности рекомендаций | |
| 1 | Четко обоснованная — опирающаяся на исследования высокого уровня доказательности относительно важных для больных исходов и стоимости терапевтического или диагностического вмешательства |
| 2 | Слабо обоснованная — разброс или неопределенность предпочтений и оценок. неуверенность в эффективности предложенных мер. чрезмерно высокая стоимость или необходимость больших затрат для осуществления |
Подход к диагностике этиологии холестаза.
Для полноценной детоксикационной функции печени и кишечного пищеварения критически важна эффективная секреция желчи. Холестаз представляет собой нарушение образования и/или оттока желчи, которое может оставаться бессимптомным или проявляться утомляемостью, зудом, неприятными ощущениями в правом верхнем квадранте живота, желтухой. Ранние биохимические маркеры холестаза — повышение уровня ЩФ и γ-глутамилтрансферазы (ГГТ) в сыворотке. Позднее повышается уровень билирубина. Холестаз расценивают как хронический при его продолжительности более 6 мес. Кроме того, его подразделяют на внутрипеченочный и внепеченочный, а по механизму расстройства образования желчи — на гепатоцеллюлярный и холангиоцеллюлярный. Желтуха представляет собой окрашивание кожи, склер и слизистых вследствие гипербилирубинемии, которое свидетельствует о тяжести холестаза, но может иметь в своей основе весьма разнообразные причины — над-, внутри- и подпеченочные (табл. 2 и 3).
Таблица 2. Дифференциальный диагноз внутри и внепеченочного холестаза у взрослых.
| Гепатоцеллюлярный холестаз |
| Алкогольный и неалкогольный стеатогепатиты |
| Доброкачественные инфильтративные процессы (амилоидоз, саркоидоз) |
| Холестаз, вызванный лекарственным препаратом (холестатиче- ская форма лекарственного поражения) |
| (Моно)генные наследственные расстройства (доброкачествен- ный рецидивирующий внутрипеченочный холестаз 1–3-го типа, прогрессирующий семейный внутрипеченочный холестаз 1–3-го типа, внутрипеченочный холестаз беременных, стойкая гепато- целлюлярная секреторная недостаточность, эритропоэтическая протопорфирия) |
| Инфильтрация опухолевыми клетками при злокачественных новообразованиях |
| Узелковая регенераторная гиперплазия |
| Паранеопластический холестаз (при лимфоме ходжкина, почеч- ноклеточном раке) |
| Сепсис |
| Полное парентеральное питание |
| Заболевания сосудов (синдром бадда—киари, синдром синусои- дальной обструкции, застойная гепатопатия) |
| Холестатическая форма вирусного гепатита |
| Холангиоцеллюлярный (билиарный) холестаз |
| Первичный билиарный холангит |
| Первичный склерозирующий холангит |
| IGG4-ассоциированный холангит |
| Вторичный склерозирующий холангит, например, при калькулезном холангите, ишемии (шоке, политравме, критических состояниях), телеангиэктазии, васкулите, инфекционных заболеваниях (вич-инфекции) и других иммунодефицитных состояниях |
| Муковисцидоз |
| Лекарственные холангиопатии |
| Мальформации дуктальной пластинки: комплексы фон мейенберга (билиарные гамартомы), синдром кароли, врожденный фиброз печени |
| Идиопатическая дуктопения |
| Реакция «трансплантат против хозяина» |
| Гистиоцитоз из клеток лангерганса |
Таблица 3. Дифференциальный диагноз билиарных поражений по гистологической картине биоптата.
| Негнойный холангит |
| Первичный билиарный холангит |
| Первичный склерозирующий холангит |
| Аутоиммунный гепатит |
| Лекарственное поражение печени |
| Саркоидоз |
| Дефицит АВСВ4 |
| Облитерирующий фиброзный холангит |
| Первичный склерозирующий холангит |
| Вторичный склерозирующий холангит |
| IGG4-ассоциированный холангит |
| Саркоидоз |
| Дефицит АВСВ4 |
| Другие холангиопатии |
| Злокачественная холангиопатия |
| Лимфома |
| Системный мастоцитоз |
| Нейтрофильный холангит |
| Эозинофильный холангит |
| Гистиоцитоз из клеток лангерганса |
Хронические холестатические заболевания печени ча- сто остаются бессимптомными месяцы и годы, сопровождаясь только повышением уровня ЩФ в сыворотке. ЩФ может поступать в сыворотку из разных источников (печени, тонкой кишки, костей, плаценты). Повышение ее сывороточного уровня наблюдается не только при холестатических заболеваниях печени, но и при быстром росте костей у детей, внепеченочных заболеваниях (на- пример, костных, таких как болезнь Педжета), дефиците витамина D, беременности. О печеночном происхождении высокого уровня ЩФ свидетельствует одновременное повышение уровня ГГТ (или 5′-нуклеотидазы) и/или конъюгированного билирубина. Для идентификации органа — источника ЩФ применяют определение ее изоформ, но на практике этот метод мало распространен, поэтому у детей более точным маркером холестаза является уровень ГГТ. Алгоритм диагностики хронического холестаза клиническими, биохимическими и визуализирующими методами, в большинстве случаев позволяющий установить его этиологию, представлен на рис. 2. В любом случае требуется системный подход.
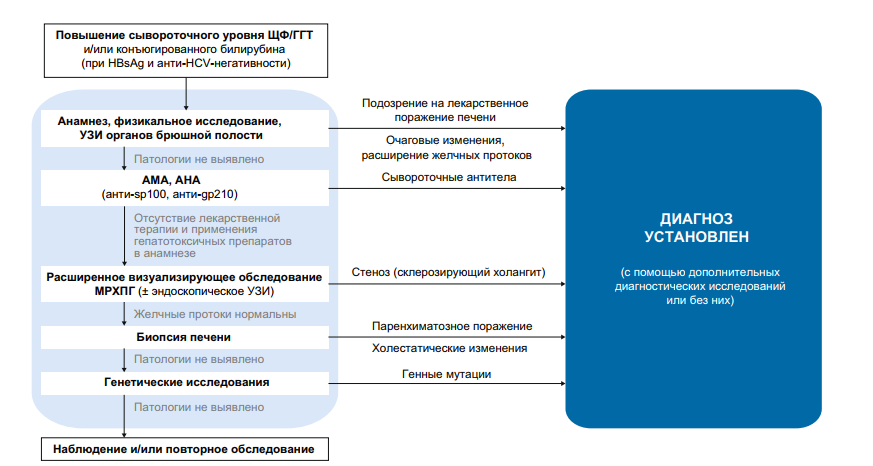
HBsAg — поверхностный антиген вируса гепатита В; HCV — вирус гепатита С.
Анамнез, физикальное исследование и УЗИ брюшной полости.
В диагностике холестатических заболеваний печени неясного происхождения часто решающее значение имеет тщательно собранный анамнез — индивидуальный (в т. ч. сведения о поездках в другие страны), социальный, семейный. ПБХ может сопутствовать аутоиммунному тиреоидиту Хасимото, синдрому Шегрена (нарушение секреции слез и слюноотделения), целиакии, системному склерозу. Воспалительные заболевания кишечника часто сопровождаются первичным склерозирующим холангитом. Вторичный склерозирующий холангит может развиться после длительной интенсивной терапии и/или тяжелой политравмы, иммуноглобулин (Ig)G4-связанный холангит — после длительного контакта с красками, дизельным топливом и другими нефтепродуктами или промышленными газами.
Лекарственный анамнез должен охватывать не только когда-либо проводившуюся и проводимую в настоящее время медикаментозную терапию, но и употребление средств нетрадиционной медицины, в т. ч. растительных, лекарственные зависимости (например, от анаболических стероидов, слабительных и т. п.), сведения о курении и употреблении алкоголя. Холестатический тип повышения уровня печеночных ферментов в сыворотке наблюдается приблизительно в 30 % случаев лекарственных поражений печени. Потенциально гепатотоксичны такие антибактериальные препараты, как амоксициллин/клавулановая кислота и триметоприм/сульфаметоксазол, анаболические стероиды, азатиоприн. Следует прекратить прием лекарственных средств, начатый за 5–90 дней до развития холестаза, если он не был прекращен ранее по другим причинам, и проследить влияние этой меры на интенсивность холестаза. Для определения вероятности лекарственного поражения печени используют шкалу оценки причинно-следственной связи Roussel Uclaf и материалы сайта National Institutes of Health https://livertox.nih.gov. Важны также указания в анамнезе на перенесенные хи- рургические вмешательства и гемотрансфузии. Физикальное исследование направлено на выявление гепато- и спленомегалии и внепеченочных признаков далеко зашедшего поражения печени, таких как желтушность кожи, склер и слизистых, ксантелазмы, эритема подошв и ладоней, изменения ногтей и расчесы, особенно на руках и ногах.
УЗИ брюшной полости — первоочередное визуализирующее исследование для исключение механической обструкции желчных путей, объемных образований, в т. ч. внепеченочных, и заболеваний желчного пузыря. УЗИ — чувствительный, неинвазивный и относительно дешевый метод, который, кроме всего прочего, применим у постели больного. Однако его информативность зависит от навыков исследователя и изменения желчных протоков могут остаться недиагностированными. При нормальной УЗИ- картине наиболее вероятен внутрипеченочный холестаз.
Серологические исследования.
При хроническом внутрипеченочном холестазе как следующий этап диагностики рекомендуется определение АМА и ПБХ-специфических АНА — иммунофлюоресцентное исследование и/или тестирование на специфические антитела (анти-sp100 и анти-gp210) с помощью вестерн-блоттинга или твердофазного иммуноферментного анализа (ELISA). Специфичность АМА при острых поражениях печени невелика. В диагностике ПБХ и других хронических холестазов неясной этиологии они высокочувствительны и специфичны (подробнее см. разд. Первоначальная диагностика ПБХ»), специфичностью исключительно в отношении ПБХ они не обладают. Распространенность АМА-серопозитивности выше (около 1:1000), чем ПБХ (около 0,4:1000). В некоторых популяциях (например, среди индейцев-шайенов в Колорадо) распространенность AMA- и ПБХ-специфичной АНА-серопозитивности без клинических проявлений ПБХ достигает 15 %.
Дополнительные визуализирующие исследования.
В руках опытных специалистов магнитно-резонансная холангиопанкреатография (МРХПГ) при холестазе служит точным и безопасным методом визуализации внутри- и внепеченочных желчных протоков. В диагностике первичного или вторичного склерозирующего холангита решающее значение имеет выявление стеноза и расширения внутри- и/или внепеченочных желчных протоков (см. табл. 2). В диагностике камней и обструкции внепеченочной желчных протоков, особенно дистальных, эндоскопическое УЗИ по информативности равнозначно МРХПГ.
Биопсия печени.
Если перечисленными методами установить причину внутрипеченочного холестаза не удалось, показана биопсия печени. Биоптат подходящего для диагностики ка чества должен включать по крайней мере 11 портальных полей.
Гистологические находки могут включать:
- изменения желчных протоков: хронический негнойный холангит, облитерирующий фиброзный холангит и более редкие холангиопатии;
- изменения вне желчных протоков: болезни накопления, инфильтративные, воспалительные и гранулематозные поражения, узелковую регенераторную гиперплазию, пелиоз, расширение синусоидов и цирроз различной этиологии;
- гепатоцеллюлярный холестаз с незначительными гистологическими изменениями или без них, наблюдающийся при доброкачественном рецидивирующем внутрипеченочном холестазе, приеме эстрогенов или анаболических стероидов, сепсисе, полном парентеральном питании или как паранеопластический феномен.
Генетическое тестирование.
Описан целый ряд наследственных синдромов, сопровождающихся холестазом (см. <https://www.ncbi.nlm.nih.gov/ omim/?term=cholestasis>). Из моногенных холестатических синдромов наиболее изучены мутации генов транспортных белков ATP8B1, ABCB11 и ABCB4, которые могут проявиться в раннем детстве, подростковом или зрелом возрасте как прогрессирующий семейный внутрипеченочный холестаз 1–3-го типа, доброкачественный рецидивирующий внутрипеченочный холестаз, персистирующая гепатоцеллюлярная секреторная недостаточность, внутрипеченочный холестаз беременных или холестатический синдром вследствие нехватки фосфолипидов. Молекулярно-генетическая диагностика этих мута- ций выполняется в специализированных лабораториях. Она показана в случаях, когда другие причины холестаза исключены и семейный анамнез, клиническая картина, данные биохимических и визуализирующих исследова- ний указывают на его моногенную наследственную при- роду. Генетическая диагностика чрезвычайно редких холестатических синдромов, таких как синдром Алажилля (дефекты генов Jagged, Notch2), PFIC4 (TJP2) и связанных с мутациями MYO5B, кодирующего виллин, или FXR, выполняется лишь в отдельных высокоспециализированных центрах и показана только при обоснованных подозрениях на эти наследственные расстройства.
Рекомендации:
- Сбор подробного анамнеза и физикальное исследование при указывающих на холестатическое заболевание результатах биохимических проб (III, 1).
- УЗИ как первоочередное неинвазивное визуализирующее исследование для дифференциального диагноза внутри- и внепеченочного холестаза (III, 1).
- Серологический скрининг на АМА и ПБХ-специфические АНА иммунофлюоресцентными методами при любом холестазе неясной этиологии (III, 1).
- МРХПГ как метод визуализации при холестазе неясной природы. Для оценки дистальных желчных протоков заменой ему может служить эндоскопическое УЗИ (III, 1).
- Биопсия печени, если серологические и дополнительные визуализирующие исследования не прояснили природы стойкого внутрипеченочного холестаза (III, 1).
- Генетическое тестирование при клинических признаках, указывающих на возможность наследственного холестатического синдрома.
Первоначальная диагностика ПБХ.
Клинические и биохимические признаки.
ПБХ следует иметь в виду при стойких биохимических признаках холестаза или жалобах на зуд и утомляемость (табл. 4). Для ПБХ характерно повышение уровня ЩФ в сыворотке, сопровождающееся дуктопенией и прогрессированием заболевания. На уровень ЩФ могут влиять не связанные с холестазом факторы, например группа крови, секреторный фенотип ABH (секреция антигенов групп крови AB0) и высокий уровень IgG при аутоиммунном гепатите (частичное совпадение синдромов аутоиммунного гепатита и ПБХ). Другая серологическая особенность ПБХ — повышение концентрации иммуноглобулинов, особенно IgM, обусловленное эпигенетическими изменениями. Возможно повышение уровня аспартат- (АсАТ) и аланинаминотрансфераз (АлАТ), отражающее воспаление и некроз печеночной паренхимы, особенно в сочетании с повышением уровня IgG. Отношение АсАТ/АлАТ > 1 указывает на прогрессирующий фиброз печени. Уровень ГГТ может повыситься раньше, чем ЩФ. Гипербилирубинемия появляется при прогрессировании ПБХ. Высокий уровень билирубина характерен для далеко зашедшего заболевания. Сопутствующие гипербилирубинемии тромбоцитопения, гипоальбуминемия и повышение международного нормализованного отношения (МНО) свидетельствуют о развитии клинически значимо- го цирроза. Холестаз влияет на уровень липидов, поэтому при ПБХ увеличивается концентрация холестерина и появляются ксантомы и ксантелазмы. Однако значимых доказательств повышения кардиологического риска при ПБХ не опубликовано. По данным эпидемиологических исследований, индивидуальными факторами риска ПБХ являются инфекции слизистых (в частности, рецидивирующая мочевая инфекция) и курение. А
| Показатель | Находка | Как настораживающий | Как диагностический | Как прогностический | Примечания |
| ЩФ | ↑ | ✓ | ✓ | ✓ | Уровень повышается по мере прогрессирования заболевания |
| АСТ и АЛТ | ↑ | ✓ | ✓ | Высокий уровень указывает на пбх с чертами аиг | |
| ГГТ | ↑ | ✓ | Отражает холестатическое поражение печени | ||
| igm | ↑ | ✓ | Повышение уровня зависит от заболевания | ||
| АМА (титр > 1:40) | + | ✓ | В соответствующих клинических ситуациях патогномоничен для ПБХ более чем в 90 % случаев | ||
| Специфические АНА | + | ✓ | Специфические типы иммунофлюоресценции (перинуклеарное кольцо, точки на ядре, флюоресценция центромер) обнаруживаются в 30 % случаев | ||
| Антитела Анти-gp210 | + | ✓ | ✓ | определение иммунологическим методом доступно | |
| Антитела Анти-sp100 | + | ✓ | Определение иммунологическим методом доступно | ||
| Антицентромерные антитела | + | ✓ | Связаны с фенотипом портальной гипертензии | ||
| Билирубин | ↑ | ✓ | Повышается на поздних стадиях; обычно свидетельствует о циррозе (кроме случаев дуктопенического нецирротического варианта) | ||
| Количество тромбоцитов | ↓ | ✓ | Указывает на цирроз | ||
| Количество тромбоцитов | ↑ | ✓ | Указывает на цирроз | ||
| Альбумин | ↓ | ✓ | Указывает на цирроз |
Иммунологические маркеры.
Для ПБХ патогномонична АМА-серопозитивность в отношении E2-субъединицы пируватдегидрогеназного комплекса. АМА-серопозитивность наблюдается более чем в 90% случаев ПБХ. Иммунофлюоресценция в титре больше 1:40 или положительный результат иммуноферментного анализа при наличии холестаза высокоспецифичны для ПБХ. АМА-серопозитивность точно указывает на ПБХ при необъяснимом ничем другим холестазе, но не при нормальных биохимических показателях функции печени. В последнем случае ПБХ в ближайшие 5 лет развивается только у 1 из 6 АМА-серопозитивных лиц. АНА обнаруживаются приблизительно у 30% больных ПБХ. Некоторые АНА высокоспецифичны для ПБХ (> 95 %), хотя и малочувствительны. Выявление путем иммунофлюоресцентного окрашивания точек в ядре, указывающее на наличие антител анти-sp100, или перинуклеарных колец, указывающих на анти-gp210-позитивность, помогает диагностировать ПБХ в 5–10 % (в зависимости от метода) АМА-серонегативных случаев. Как показывает опыт, во избежание диагностических ошибок иммунные маркеры следует оценивать в контексте клинических находок. Например, иногда АМА- серопозитивностью сопровождаются системные заболевания в частности гематологические, и гранулематозный гепатит.
Визуализирующие исследования.
ПБХ не вызывает морфологических изменений печени, поддающихся визуализации. УЗИ органов брюшнойполости при подозрении на ПБХ необходимо, чтобы исключить внепеченочную этиологию холестаза и новообразований печени, а также выявить признаки далеко зашедшего поражения, те же, что и при других заболеваниях: очаговые изменения, портальная гипертензия, спленомегалия, асцит. При ПБХ часто наблюдается увеличение лимфоузлов ворот печени.
Гистологические характеристики.
Гистологическая картина ПБХ характеризуется хроническим негнойным воспалением вокруг внутридольковых и септальных желчных протоков, разрушающим их. Его описывают как «цветущее поражение» (рис. 3). Часто оно обнаруживается уже в начальных стадиях заболевания. Воспалительные инфильтраты состоят преимущественно из T-лимфоцитов с небольшой примесью B-лимфоцитов, макрофагов и эозинофилов. Иногда наблюдаются эпителиоидные гранулемы. Прогрессирующее поражение желчных протоков приводит к дуктопении, воспалению и отложению коллагена. По степени этих изменений ПБХ, согласно классификации Ludwig и Scheuer, подразделяют на стадии 1–4. Стадии 4 соответствуют признаки цирроза. Недавно предложена новая система классификации стадий ПБХ на основании оценки активности хронического холангита и гепатита. Она включает 4 стадии соответственно оценке по 4-балльной шкале (0–3) трех гистологических показателей: фиброза, утраты желчных протоков и отложения орсеин-положительных гранул. Оценка 0 соответствует 1-й стадии (отсутствие или минимальность прогрессирования), 1–3 — 2-й (легкое прогрессирование), 4–6 — 3-й (умеренное прогрессирование), 7–9 — 4-й (далеко зашедшее поражение).
Новая классификация превосходит прежнюю в прогнозировании исходов через 10 лет, в частности развития цирроза и его осложнений. Учитывая высокую специфичность серологических маркеров, биопсия для подтверждения диагноза ПБХ необязательна. Необходимость в ней возникает только при отсутствии специфичных для ПБХ антител или подозрении на сопутствующий аутоиммунный гепатит либо неалкогольный стеатогепатит (НАСГ), в некоторых случаях — при наличии системных или внепеченочных сопутствующих заболеваний.
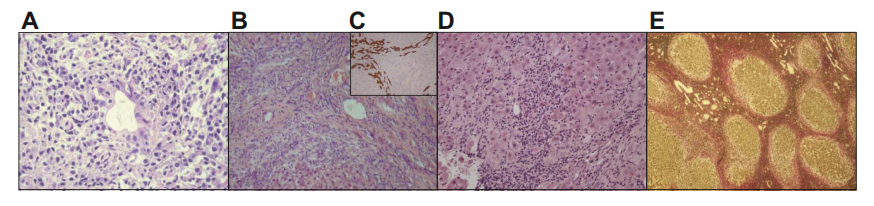
(A) Лимфоцитарный холангит: выраженные воспалительные изменения желчных протоков в виде плотной перидуктальной инфильтрации с разрывами эпителия протоков (окраска гематоксилином и эозином).
(B, C) Утрата желчных протоков и дуктулярная реакция: расширенный портальный тракт, содержащий разветвления артерии без сопровождающих их желчных протоков. Краевая дуктулярная реакция с рыхлым фиброзом (пограничная билиарная активность; окраска гематокси- лином и эозином). Иммуногистохимическое исследование на кератин 7 подтверждает отсутствие правильно сформированных желчных протоков и выраженную краевую дуктулярную реакцию (окраска иммунопероксидазой).
(D) «Пограничный» гепатит: картина выраженного «пограничного» гепатита с баллонирующей дегенерацией гепатоцитов, образованием розеток, изолированием перипортальных гепатоцитов указывает на сопутствующий аутоиммунный гепатит. Имеются также очаги эмпериполеза лимфоцитов (окраска гематоксилином и эозином).
(E) Цирроз: сформировавшийся цирроз с широкими фиброзными перегородками, окружающими мелкие узлы гепатоцитов. Фиброзные перегородки окаймлены зоной рыхлого фиброза, характерной для хронического билиарного поражения (окраска гематоксилином по Ван-Гизону). Наиболее широко для оценки тяжести ПБХ по гистологической картине используются 2 классификации: по Scheuer (1967 г.) и по Ludwig (1978 г.). Обе они выделяют 4 стадии заболевания с подкатегориями в зависимости от сочетания портального и перипортального воспаления, дуктулярной реакции и фиброза (4-я стадия — цирроз). Более новая (2010 г.) классификация стадий ПБХ Nakanuma опирается на 3 наиболее полно отражающих прогрессирование признака: фиброз, утрату желчных протоков и наличие орсеин-положительных гранул в гепатоцитах.
Рекомендации.
- У взрослых с холестазом в отсутствие признаков системного заболевания основанием для диагноза ПБХ может быть повышение уровня ЩФ в сочетании с титром АМА > 1:40 (III, 1).
- При АМА-серонегативности основанием для диагноза ПБХ при холестазе может служить АНА-специфическая флюоресценция в виде пятен в ядре или перинуклеарных колец либо положительный результат твердофазного иммуноферментного анализа на sp100 или gp210 (III, 1).
- Биопсия печени для подтверждения диагноза ПБХ необходима только при отсутствии ПБХ-специфических анти- тел или подозрении на сопутствующее заболевание печени (аутоиммунный гепатит, НАСГ, поражение системным заболеванием) (III, 1).
- Изолированная АМА-серопозитивность служит не основанием для диагноза ПБХ, а лишь показанием для наблюдения с ежегодным определением биохимических параметров функции печени (III, 1).
Стратификация уровней риска при ПБХ.
Даже при терапии УДХК прогрессирование ПБХ может продолжаться и приводить к печеночной недостаточности и смерти, поэтому у всех больных ПБХ необходимо оценивать риск прогрессирования до терминальной стадии и потенциальную потребность в дополнительном лечении (рис. 4). Маркеры уровня риска можно подразделить на динамические и статические в зависимости от того, влияет ли на них терапия. Статические маркеры остаются неизменными в любые сроки с момента постановки диагноза. В числе маркеров демографические, клинические и общепринятые биохимические показатели, серологический профиль, сывороточные маркеры фиброза, показатели эластометрии печени, гистологические признаки, уровень давления в воротной вене при прямом измерении.
Помощь всегда строится с учетом индивидуальных особенностей больного и условий здравоохранения данной страны, но ее эффективность обеспечивают эти 3 опорных элемента.
Демографические показатели.
Возраст и пол влияют на эффективность терапии ПБХ и отдаленный исход. Если заболевание начинается в возрасте до 45 лет, оно чаще сопровождается клиническими проявлениями и хуже поддается общепринятой терапии УДХК. Это отражает более высокий показатель стандартизованной относительной смертности, особенно по связанным с заболеванием печени причинам, в данной возрастной группе, в то время как более пожилые больные чаще умирают по не связанным с заболеванием печени причинам. У мужчин чаще ПБХ диагностируется относительно поздно, в более далеко зашедшей стадии. Биохимические показатели у них реагируют на терапию УДХК слабее, и риск развития гепатоцеллюлярного рака выше. Является ли пол при ПБХ независимым прогностическим фактором, пока неясно.
Симптомы.
Утомляемость и зуд наблюдаются более чем в половине случаев ПБХ. Тягостные для больных симптомы и их природа рассмотрены в разделе о ведении ПБХ и его печеночных и внепеченочных проявлений. Клинические проявления следует оценивать в комплексе с другими показателями тяжести заболевания. Клиническая картина утяжеляется по мере его прогрессирования. Выраженность симптомов является неблагоприятным прогностическим фактором ответа на УДХК-терапию и исхода. Описан вариант ПБХ с ранней дуктопенией, при котором холестатическая желтуха сопровождается тяжелым зудом и УДХК не облегчает течение. Биопсия выявляет исчезновение желчных протоков без значительного фиброза или цирроза. Заболевание бы- стро прогрессирует до стадии, когда единственным средством спасения становится ТП. Опубликованные данные относительно прогностического значения симптомов противоречивы, что, возможно, объясняется сведением в одну категорию утомляемости и зуда, отсутствием стандартизованных количественных оценок, анализа динамики развития симптомов и проспективного наблюдения, вмешивающимися факторами и неизбежной вариабельностью субъективных оценок. Жалобы на резкую утомляемость не всегда соответствуют тяжести поражения печени и скорее служат фактором риска смерти по не связанным с заболеванием печени причинам.
Стандартные биохимические показатели функции печени.
С 1970-х годов высокий уровень билирубина в сыворотке рассматривается как главный предиктор неблагоприятного исхода. По уровню билирубина в сочетании с уровнем альбумина до начала УДХК-терапии можно выделить 3 категории риска:
- низкий (при нормальном уровне обоих показателей);
- средний (отклонение от нормы только одного из них);
- высокий (при сочетании гипербилирубинемии с гипоальбуминемией).
В определении уровня риска у получающих УДХК больных эффективны также шкала риска Мейо и шкала MELD (модель терминальной стадии болезни печени). Однако гипербилирубинемия и гипоальбуминемия развиваются только на очень поздней стадии ПБХ. Оценить риск по уровням билирубина и альбумина на ранних стадиях невозможно. Судить о нем позволяет только ответ на терапию УДХК.
Серологический профиль.
ПБХ-специфические АНА (антитела к антигенам gp210 и sp100) чаще обнаруживаются при тяжелом течении ПБХ и считаются неблагоприятным прогностическим фактором независимо от уровня билирубина. Возможно, прогностическое значение в отношении портальной гипертензии имеют антицентромерные антитела. Однако количество длительных наблюдений недостаточно, чтобы судить, насколько пригоден в клинической практике профиль антител как надежный прогностический показатель.
Сывороточные маркеры фиброза.
В распоряжении клиницистов есть несколько сывороточных маркеров фиброза, позволяющих оценить уровень риска при ПБХ. Первый маркер, уровень которого проемонстрировал значимую связь с клиническими исходами, — гиалуроновая кислота. Усиленная шкала фиброза печени (enhanced liver fibrosis, ELF), оценка по которой рассчитывается на основании одновременно определенных концентраций гиалуроновой кислоты, пептида проколлагена III и тканевого ингибитора металлопротеиназы-1, показала такую же прогностическую ценность. Недавно исследована значимость как предиктора неблагоприятных событий в разных группах больных индекса отношения уровня АсАТ к количеству тромбоцитов, самого по себе или в сочетании с реакцией на терапию УДХК. Опубликованы данные о прогностической значимости уровней агглютинин wisteria floribunda- позитивного mac-2-связывающего белка (WFA+ -M2BP) и цитокератина 18, но они нуждаются в подтверждении.
Эластометрия печени.
Эластичность печени, измеренная путем ультразвуковой эластографии с контролем вибрации (VCTE), показала себя лучшим суррогатным маркером цирроза и тяжелого (например, мостовидного) фиброза при ПБХ. Кроме того, показатель эластометрии печени выше 9,6 кПа сопровождается 5-кратным увеличением риска печеночной недостаточности, смерти и необходимости ТП. Более информативна, чем сам по себе показатель эластометрии, в отношении исхода ПБХ отрицательная динамика этого показателя, поэтому он может быть использован как суррогатный маркер прогрессирования ПБХ. По данным упомянутого исследования, у получавших УДХК больных с циррозом показатель эластометрии за период наблюдения значительно ухудшился. Исходя из его результатов, European Association for the Study of the Liver (EASL) и Asociacion Latinoamericana para el Estudio del Higado (EASLALEH) рекомендуют использовать VCTE для контроля прогрессирования ПБХ, хотя данных для определения ее оптимальных пороговых показателей и периодичности применения пока недостаточно. По самым последним данным, при ухудшении показателя эластометрии более вероятна слабая реакция биохимических показателей функции печени на терапию УДХК. Таким образом, VCTE представляет собой новую возможность прогнозирования исходов ПБХ. Большое совместное исследование выявило надежность показателя эластографии, его межквартильного интервала и медианного значения как независимых критериев. Применение VCTE входит в число современных рекомендаций.
Гистологические характеристики.
Гистологическая картина поздних стадий всегда служит предиктором неблагоприятного прогноза ПБХ. Для диагностических целей биопсию уже не используют. Общепринятым методом диагностики цирроза и тяжелого фиброза может быть VCTE, поэтому гистологическое исследование имеет для прогнозирования исхода ПБХ ограниченное значение. Однако биопсия может быть полезна для качественной и количественной оценки гистологических изменений, лежащих в основе неадекватного ответа на УДХК-терапию. Выраженный «пограничный» лимфоцитарный гепатит является независимым прогностическим фактором развития цирроза или других серьезных неблагоприятных событий; дуктопения наряду со слабым биохимическим ответом на УДХК — предиктором прогрессирования гистологических изменений. Кроме того, гистологическое исследование классическими методами подкрепляет значимость ответа на УДХК-терапию как предиктора отдаленного исхода. Наконец, новые методы окраски гистологических препаратов и классификационные системы отражают тяжесть дисфункции печени до УДХК-терапии. Их результаты тесно коррелируют с последующим развитием цирроза и его осложнений. Таким образом, биопсия при ПБХ дает дополнительную информацию для определения уровня риска. Учитывая соотношение преимуществ и риска, эта инвазивная процедура может быть оправдана при слабом биохимическом ответе на УДХК.
Прямое измерение портального давления.
Результаты прямого измерения градиента венозного давления в печени (ГВДП) при ПБХ коррелируют с риском смерти или необходимости ТП. Снижение ГВДП после 2 лет УДХК-терапии наблюдается у больных с благоприятным прогнозом. Однако с появлением неинвазивных методов косвенной оценки уровня портальной гипертензии (например, эластометрии) инвазивное прямое измерение в повседневной практике избегают.
Характеристика недостаточного ответа на терапию.
Характеризовать терапию как неэффективную позволил бы надежный суррогатный оценочный показатель постепенного прогрессирования заболевания, значимость которого подтверждена исследованиями в разных группах больных. Перспективным в этом отношении методом является эластометрия, но ее значимость как суррогатного маркера прогрессирования пока недостаточно проверена. Напротив, надежность динамики стандартных биохимических показателей функции печени на фоне терапии как простого и информативного диагностического инструмента подтверждена последними 10 годами широкого использования. Ответ на УДХК-терапию поддается оценке по модели дискретных бинарных переменных или балльных оценочных систем на основе расчета непрерывных переменных (табл. 5).
Таблица 5. Критерии ответа на УДХК-терапию при ПБХ.
| Бинарные качественные критерии | Длительность,мес | Критерий неэффективности терапии |
|---|---|---|
| Рочестерские [101] | 6 | Уровень ЩФ ≥ 2 × ВГН или оценка по шкале Мейо ≥ 4,5 |
| Барселонские [62] | 12 | Снижение уровня ЩФ ≤ 40 % и уровень ЩФ ≥ 1 × ВГН |
| Парижские-I [63] | 12 | Уровень ЩФ ≥ 3 × ВГН, или АсАТ ≥ 2 × ВГН, или билирубина > 1 мг/дл |
| Роттердамские [102] | 12 | Уровень билирубина ≥ 1 × ВГН и/или альбумина |
| Торонтские [98] | 24 | Уровень ЩФ > 1,67 × ВГН |
| Парижские-II [104] | 12 | Уровень ЩФ ≥ 1,5 × ВГН, или АСТ ≥ 1,5 × ВГН, или билирубина > 1 мг/дл |
| Эхимские [103] | 6 | Снижение уровня ГГТ ≤ 70 % и уровень ГГТ ≥ 1 × ВГН |
|
Шкалы балльной оценки непрерывных переменных |
Длительность,мес | Критерии оценки |
| UK-PBC [107] | 12 |
Уровень билирубина, ЩФ и АсАТ (или АлАТ) после 12-месячной терапии; Исходный уровень альбумина и количество тромбоцитов |
| GLOBE [106] | 12 |
Уровень билирубина, ЩФ, альбумина и количество тромбоцитов после 12-месячной терапии; Возраст к моменту начала терапии |
Качественные бинарные определения.
Для характеристики биохимического ответа на УДХК пред ложено несколько определений. Все они, за исключением Торонтских критериев, получены путем проспективных наблюдений малых и средних групп больных в отдельных клиниках. Торонтские критерии прогнозируют прогрессирование гистологических изменений. Как и другие подобные системы определений, качественные бинарные характеристики предназначены облегчить практическому врачу прогнозирование неблагоприятного исхода, например смерти или необходимости ТП.
Надежность большинства из них оценивалась по результатам 12-месячной УДХК-терапии, однако, по последним данным, для достоверного прогноза достаточно оценки в течение 6 мес. Большинство исследований выявило недостаточный ответ на УДХК у 25–50 % больных в зависимости от использованных критериев. Международный консенсус признал наиболее важными критериями уровни ЩФ и общего билирубина. Этим объясняется повышение эффективности Парижских критериев-I при разграничении групп низкого и высокого риска в ряде независимых крупных исследований. Сочетанное применение Парижских критериев-I и индекса отношения уровня АсАТ к количеству тромбоцитов после 1 года УДХК-терапии позволяет оценить уровень риска еще точнее. Уровень ЩФ прогностически значим при любых пороговых значениях. Точность при использовании как пороговых превышений верхней границы нормы в 1,5, 1,67 и 3 раза заметно не отличается. Важен пороговый уровень применительно к стадии заболевания, т. к. от последней зависит эффективность УДХК. Для более точного прогнозирования в ранней стадии, которая имеет место более чему 2/3 больных исследованных в последнее время групп, предназначены Парижские критерии-II.
Системы количественной оценки непрерывных переменных.
Прогностические инструменты на основе дихотомических критериев просты и удобны в клинической практике, но не охватывают всей прогностически важной информации и нередко дают неоднозначные результаты при отнесении больных к группам высокого или низкого риска. Кроме того, они не принимают во внимание другие прогностические показатели, например маркеры стадии заболевания. В связи с этим Global PBC Study Group (<http://www.globalpbc.com/ globe>) и консорциум UK-PBC (www.uk-pbc.com) направили усилия на разработку новых систем количественной оценки непрерывных переменных, включающей как оценку ответа на терапию, так и показатели тяжести заболевания. Обе шкалы, GLOBE и UK-PBC, демонстрируют более высокую прогностическую точность, чем лучшая из бинарныхмоделей — Парижские критерии-I. По точности количественной оценки риска обе шкалы близки друг к другу.
Шкалы GLOBE при отнесении больных к группе высокого и низкого риска на 10 % точнее Парижских критериев-I. При оценке по шкале GLOBE у 40 % больных ожидаемая продолжительность жизни без ТП по сравнению с контрольной группой здоровых людей невелика. Результаты применения шкалы UK-PBC пока не опубликованы. Новые прогностические модели используются недавно. Кроме того, их надежность не проверялась вне стран Запада. Не установлено, повысит ли их точность введение в шкалы показателя эластометрии.
Рекомендации по применению диагностических инструментов при ПБХ.
Диагностические инструменты важны в клинической практике с нескольких точек зрения. В первую очередь, для отбора в условиях обычной помощи или клинических исследований больных, которым показана терапия второй линии. Во-вторых, для стратификации участников по группам риска и оценки неоднородности по ожидаемому исходу при включении в клинические исследования. В табл. 6 представлены инструменты прогнозирования при ПБХ с классификацией пригодности и надежности на 3 уровня (высокий, умеренный и неопределенный). Биохимический ответ на 12-месячную УДХК-терапию является наиболее проверенным и легко применимым критерием отбора больных, которым необходима терапия второй линии. Обычно руководствуются результатами 12-месячного применения, но результаты 6-месячного не менее точны. Наиболее прогностически значимы 2 показателя: ЩФ и билирубин. Простыми, удобными и надежными инструментами отбора являются Парижские критерии-I и -II, немногим менее точные, чем шкалы оценки риска по непрерывным переменным. В клинических исследованиях целесообразно использовать оба под- хода: качественный и количественный.
Таблица 6. Инструменты рациональной стратификации риска при ПБХ.
| Уровень пригодности | Инструменты прогнозирования |
|---|---|
| Высокий (высокая пригодность, высокая надежность |
• Уровень ЩФ и билирубина как показатель ответа на УДХК-терапию; Используются бинарные критерии или шкалы балльной оценки; • Исходная стадия заболевания (ранняя vs поздняя) по данным эластографии, уровню сывороточного билирубина и альбумина или гистологической картине |
|
Умеренный (высокая пригодность, надежность подтверждена недостаточно) |
• Показатель эластометрии; • Индекс отношения уровня АсАТ к количеству тромбоцитов; • Маркеры усиленного фиброза печени; |
|
Неопределенный (ограниченная применимость и/или надежность) |
• Возраст, пол и профиль симптомов; • ПБХ-специфичные АНА; • Степень выраженности «пограничного» гепатита и дуктопении; • Новые шкалы гистологической оценки; • Прямое измерение портального давления. |
Исходную стадию заболевания расценивают как раннюю или далеко зашедшую по:
- гистологическим находкам (если проводилась биопсия): легкий фиброз или его отсутствие vs мостовидный фиброз или цирроз;
- показателю эластографии: ≤ 9,6 vs > 9,6 кПа;
- уровню билирубина и альбумина в сыворотке: нормальный обоих показателей vs отклонение от нормы хотя бы одного.
Это простые и действенные инструменты стратификации риска в клинических исследованиях. Подтверждена также действенность и надежность VCTE, доступного в ряде стран и клинических центров экспертного уровня, как метода диагностики далеко зашедших стадий ПБХ. В настоящее время он рассматривается как метод выбора для стратификации больных в клинических исследованиях. Кроме того, эластометрию, ухудшение показателя которой служит предиктором неблагоприятного исхода, можно использовать для контроля прогрессирования ПБХ.
Рекомендации.
- Терапия ПБХ направлена на предупреждение развития терминальной стадии цирроза и его осложнений и облегчение сопутствующих симптомов (III, 1).
- Всем больным показана оценка риска прогрессирования ПБХ (III, 1).
- Наиболее высок риск осложнений ПБХ при недостаточном биохимическом ответе на терапию и при циррозе (II-2, 1).
- Наиболее значимым прогностическим фактором недостаточного биохимического ответа на терапию является относительно молодой возраст (< 45 лет) и далеко зашедшая стадия к моменту постановки диагноза (III, 1).
- Всем больным должна исходно и в процессе наблюдения проводиться оценка стадии заболевания несколькими неинвазивными методами (определение уровней билирубина, ЩФ, АсАТ, альбумина, количества тромбоцитов и показателя эластометриии) (III, 1).
- Как суррогатные прогностические маркеры исхода ПБК можно использовать повышение уровня билирубина и ЩФ. Надежность других общепринятых биохимических и гематологических показателей как инструментов оценки индивидуального риска прогрессирования ПБК нуждается в подтверждении (II-2, 1).
- Следует учитывать, что выживаемость до момента необходимости трансплантации у больных с ранней стадией ПБХ при уровне ЩФ, не превышающем верхнюю границу нормы более чем в 1,5 раза, и нормальном уровне билирубина после 1 года терапии УДХК значимо не отличается от таковой в контрольной группе здоровых людей (II-2, 1).
- Использование при ПБХ эластометрии и шкал оценки риска, таких как GLOBE и UK-PBC, помогает лучше оценить индивидуальный риск осложнений далеко зашедшего заболевания в будущем (III, 1).
Лечение: терапия, направленная на замедление прогрессирования заболевания.
Терапевтическая стратегия ПБХ опирается в основном на желчные кислоты. Воспроизводимых и неоднозначных данных в пользу применения других препаратов, в т. ч. иммунодепрессантов, исследования не показали. Результаты этих исследований описаны в ранее опубликованных рекомендациях и обзорах и здесь не приводятся. ПБХ прогрессирует медленно, и отдельных исследований для оценки вероятности смерти или ТП как средства спасения недостаточно. Предпринималось много исследований по оценке клинической эффективности УДХК (в первую очередь) и информативности суррогатных биохимических параметров. Из-за разнообразия критериев включения и отсутствия в ряде исследований стратификации по индивидуальному риску и стадиям заболевания сообщения об эффективности терапии противоречивы: больные группы низкого риска оставались в ней независимо от терапии, а у больных группы высокого риска реакция на терапию была недостаточной. Чтобы правильно оценить имеющиеся в литературе данные, крайне важно учитывать их неоднородность и влияние стадии заболевания на действенность терапии. Она определяется не од- ним только механизмом действия препарата, но и зависит от уровня риска прогрессирования и стадии заболевания.
Лицензированные показания.
Урсодезоксихолевая кислота.
Эффективность приема УДХК многократно исследована. AASLD (Американская ассоциация по изучению болезней печени) и EASL (в т. ч. и в настоящем документе) рекомендуют назначать УДХК всем больным ПБХ. УДХК составляет около 1–3 % желчных кислот, но при приеме ее препарата внутрь становится преобладающей. Степень обогащения желчи ею коррелирует с улучшением биохимических показателей функции печени.
УДХК представляет собой посттранскрипционный стимулятор секреции гепатоцитов и холангиоцитов, а также стимулирует перенос через мембраны последних посредством мощной активации посттранскрипционного сигнального пути транспортных белков и каналов. При холестатических состояниях этот механизм и обеспечиваемая им секреция HCO3 – , желчных кислот, билирубина и ряда других холефилов нарушается.
По опубликованным данным, оптимальная доза УДХК составляет 13–15 мг/кг в сутки за один или (в целях лучшей переносимости) два приема. Согласно отдельным сообщениям, некоторые больные лучше переносят жидкие лекарственные формы УДХК для приема внутрь. Опубликованные данные указывают на преимущества дозы 13–15 мг/кг по сравнению с дозами 5–7 и 23–25 мг/кг в сутки.
Оценивая литературные данные, следует учитывать, что в некоторых ранних исследованиях использовались дозы ниже принятых в настоящее время за оптимальные. УДХК вполне безопасна. Ее побочное действие при приеме в рекомендованных дозах минимально: прибавка массы тела около 3 кг в первые 12 мес. терапии, истончение волос, изредка — диарея и метеоризм. Сообщений о тератогенности УДХК не опубликовано, как и данных доказательных исследований ее применения у беременных и кормящих женщин.
Прием УДХК до беременности, в I и последующих триместрах и при естественном вскармливании считают безопасным, благодаря чему препарат применяют при внутрипеченочном холестазе беременных. Опубликовано 3 крупных рандомизированных исследования УДХК в одних и тех же дозах (13–15 мг/кг) с двойным слепым контролем и анализом результатов у всех начавших лечение больных. В 2 исследованиях основным оцениваемым показателем служил «сборный» показатель неэффективности терапии, в 3-м — относительное (в %) изменение уровня билирубина за 2 года. Проявления побочного действия УДХК были небольшими, и частота ее отмены во всех 3 исследованиях не превышала 20 %. Из 3 исследова- ний 2 были построены по перекрестному плану. Часть больных, которые при рандомизации были отнесены к группе плацебо, через 24 мес. стали участниками открытого исследования УДХК. Однако при анализе результатов их отнесли к группе плацебо, т. к. он проводился по принципу первоначального включения в терапию. Совместный анализ результатов всех 3 исследований (548 больных) показал снижение риска смерти или необходимости ТП при тяжелом и средне- тяжелом ПБХ на 1 /3 . Преимуществ терапии при уровне общего билирубина ниже 68 мкмоль/л и/или I–II стадии гистологических изменений на момент включения исследование не выявило. Важно отметить, что у больных, начавших получать УДХК после 24-месячной плацебо-терапии, течение заболевания оставалось неблагоприятным. Дальнейшее рандомизированное исследование (151 участник) касалось меньших доз (10–12 мг/кг в сутки) и различных препаратов УДХК. Разницы в выживаемости после 2 лет терапии не наблюдалось (8 умерших среди получавших УДХК и 12 — среди получавших плацебо). При продолжении наблюдения благоприятного влияния терапии на выживаемость также не выявлено.
Французское исследование выявило 5-кратное снижение ежегодной частоты прогрессирования ранней стадии поражения печени в распространенный фиброз или цирроз у получавших УДХК больных (7 vs 34 % у получавших плацебо; p < 0,002) при 4-летней вероятности задержки на ранней стадии 76 % (vs 29 % в группе плацебо). Проспективное исследование защитного действия УДХК в отношении пищеводного варикоза у 180 больных ПБХ показало, что у получавших терапию 4-летняя вероятность его развития значительно ниже, чем в отсутствие терапии (16 vs 58 %; p < 0,001).
Четкие подтверждения терапевтической эффективности УДХК дал метаанализ отдельных случаев (4845), опубликованных вне спланированных исследований, выполненный Global PBC Study Group. Он показал значительное увеличение продолжительности жизни без ТП у получавших ее больных по сравнению с неполучавшими (90, 78 и 66 % vs 79, 59 и 32 % с продолжительностью жизни более 5, 10 и 15 лет соответственно; для всех p < 0,001).
Приблизительно в половине из 16 рандомизированных плацебо-контролируемых исследований УДХК высока вероятность искажений. Все исследования продемонстрировали улучшение биохимических показателей функции печени под влиянием терапии. Корректированный на основании современных публикаций метаанализ Cochrane показал, что у получавших УДХК реже наблюдались явный асцит и желтуха, но разницы в частоте кровотечений из варикозных узлов и печеночной энцефалопатии по сравнению с получавшими плацебо не было. Опубликованные исследования свидетельствуют о том, что наиболее эффективно длительное применение УДХК, начатое на ранней стадии заболевания. Упомянутый метаанализ охватывал только исследования, в которых УДХК применялась в надлежащих дозах (> 10 мг/кг в сутки) и срок наблюдения составлял не менее 2 лет. В метаанализ вошло 1038 больных (522 получавших УДХК и 516 получавших плацебо). Терапия оказала выраженное благоприятное действие на биохимические показатели функции печени. Гистологические изменения прогрессировали как у получавших УДХК, так и у получавших плацебо больных, но в отсутствие фиброза (при I–II стадии заболевания) УДХК замедляла прогрессирование. Умерло или подверглось ТП 160 получавших УДХК и 186 получавших плацебо больных. В модели с фиксированным эффектом разница между группами достигает лишь пограничных значений (отношение шансов 0,76; 95%-й доверительный интервал 0,57–1,00; p = 0,05). В модели со случайными эффектами разницы нет (отношение шансов 0,77; 95%-й доверительный интервал 0,50–1,21; p = 0,30).
Рекомендации.
- УДХК в дозе 13–15 мг/кг в сутки является препаратом пер- вой линии во всех случаях ПБХ и обычно применяется пожизненно (I, 1).
Обетихолевая кислота.
FXR — ядерный лиганд-активирующий рецептор, обильно представленный в тканях, участвующих в энтерогепатической циркуляции желчных кислот. В отличие от УДХК, действующей на посттрансляционном уровне, сигнальный путь FXR непосредственно регулирует гены синтеза, секреции, транспорта и детоксикации и влияет на воспаление, метаболическую регуляцию и фиброз печени.
Обетихолевая кислота (ОБХК) — полусинтетический аналог гидрофобных желчных кислот, высокоселективный по отношению к FXR. Активирующая эффективность ОБХК во много раз выше, чем ее эндогенного аналога — хенодезоксихолевой кислоты. ОБХК так-же вызывает экспрессию вырабатываемых слизистой кишечника гормонов, в частности FGF-19.
Первое многоцентровое рандомизированное исследование ОБХК с двойным слепым контролем оценивало эффективность трех ее доз (10, 25 и 50 мг/кг в сутки) в дополнение к УДХК-терапии при ПБХ со стойким повышением уровня ЩФ в сыворотке более чем в 1,5 раза выше верхней границы нормы. Основным оцениваемым показателем в этом исследовании было снижение уровня ЩФ в сыворотке против первоначального под влиянием каждой из доз ОБХК по сравнению с плацебо. У 87, 69 и 7 % больных, получивших полный курс ОБХК, уровень ЩФ снизился соответственно по крайней мере на 10 и 20 % или до нормы (из получавших плацебо — у 14, 8 и 0 % соответственно).
Опубликовано клиническое исследование III фазы POISE, охватывавшее исключительно больных ПБХ со стойким повышением уровня сывороточной ЩФ и отсутствием ответа на терапию согласно модифицированным Торонтским критериям (уровнем ЩФ > 1,67 раза выше верхней границы нормы и/или и повышенным менее чем в 2 раза относительно верхней границы нормы уровнем общего билирубина). Основным оцениваемым показателем во время 12-месячного периода двойного слепого контроля был биохимический ответ — снижение уровня ЩФ ниже порога, превышающего в 1,67 раза верхнюю границу нормы (≥ 15 % от исходного), и нормализация уровня билирубина. По данным анализа всех начавших терапию больных, биохимический ответ наступил у 10 % участников группы плацебо и у 47 и 46 % получавших ОБХК 10 или 5–10 мг/кг в сутки соответственно (p < 0,0001 для обоих вариантов).
При обоих вариантах доз достигнуты предустановленные второстепенные оцениваемые показатели — снижение уровня АсАТ и общего билирубина в сыворотке (для обоих вариантов p < 0,001 vs плацебо). Период исследования с двойным слепым контролем ограничивался 12 мес., после которых исследование продолжалось как открытое. Для подтверждения долгосрочного эффекта ОБХК и приложения результатов к популяции больных ПБХ в целом необходимы проспективные исследования.
В настоящее время проводится продолжительное рандомизированное исследование для подтверждения благоприятного влияния ОБХК на выживаемость. Данных о ее терапевтической активности в зависимости от исходного повышения уровня ЩФ в литературе нет. Дополнительные преимущества может дать использование других суррогатных оценочных показателей, в т. ч. отношения уровня АсАТ к количеству тромбоцитов и результатов ультразвуковой эластометрии.
Прием ОБХК сопровождался дозозависимым усилением зуда, послужившим причиной прерывания терапии у 1–10 % больных, что указывает на важность подбора дозы путем ее постепенного увеличения и свое- временное назначение средств, ослабляющих зуд, предпочтительно рифампицина, а не секвестрантов желчных кислот, взаимодействие которых с ОБХК может привести к ее потере с калом. ОБХК может также вызывать обрати- мые изменения уровня липидов в сыворотке, в частности снижение уровня липопротеидов высокой плотности (ЛПВП) и общего холестерина. По данным клинического исследования III фазы, уровень липопротеидов низкой плотности (ЛПНП) слегка повышался в первые 2 нед. терапии и в дальнейшем не отличался от исходного. Влияют ли эти изменения на отдаленный сердечно-сосудистый риск, пока неизвестно. Ограничены и данные анализа экономической эффективности применения ОБХК.
Рекомендации.
- Подтверждение биохимической эффективности перорального применения ОБХК получено в исследовании III фазы у больных с уровнем ЩФ > 1,67 раза выше верхней границы нормы и повышением уровня билирубина менее чем до 2-кратной верхней границы нормы. ОБХК показана в дополнение к УДХК при недостаточном ответе на нее или как монотерапия при ее непереносимости. EASL считает показанным применение ОБХК в подобных случаях в начальной дозе 5 мг с последующим увеличением за 6 мес. до 10 мг в зависимости от переносимости (I, 2).
Препараты, применяемые вне лицензированных показаний.
Будесонид.
Будесонид — синтетический кортикостероид, который интенсивно метаболизируется до попадания в системный кровоток при первичном прохождении через печень, а потому обладает минимальным по сравнению с преднизолоном побочным действием. При далеко зашедшем поражении печени метаболизм будесонида снижается, что при циррозе и портальной гипертензии может повлечь за собой неблагоприятные последствия. Имеются единичные сообщения о благоприятном влиянии будесонида в сочетании с УДХК на гистологическую картину и биохимические показатели при ПБХ с выраженными проявлениями «пограничного» гепатита.
Основанием для применения будесонида послужила связь повышения уровня сывороточных аминотрансфераз с «пограничным» гепатитом и прогрессированием ПБХ. Однако повышение уровня аминотрансфераз может быть и следствием холестатического повреждения гепатоцитов, отличающегося от паренхиматозного воспаления. Желчные кислоты в нетоксичных, недетергентных концентрациях индуцируют экспрессию и секрецию медиаторов воспаления, тогда как в высоких — апоптоз, а в очень высоких — даже не- кроз. С этой точки зрения иммуносупрессия не может оказывать благоприятное действие. Однако примечательно, что in vitro будесонид и УДХК оказывают синергичное дей- ствие, усиливая экспрессию AE2, защищающую желчные протоки.
Рандомизированное плацебо-контролируемое исследование 1999 (39 больных) — первое посвященное применению будесонида (9 мг/кг в сутки) в дополнение к УДХК. В результате 2-летней комбинированной терапии значительно снизился уровень сывороточной ЩФ и уменьшились гистологические изменения согласно классификации Ludwig. По данным более позднего 3-летнего рандомизированного исследования (77 больных ПБХ без цирроза), комбинированная терапия будесонидом в дозе 6 мг/сут + УДХК (46 больных) сопровождалась уменьшением фиброза печени на 25 %.
Однако при монотерапии УДХК вопреки ободряющим результатам часто наблюдается прогрессирование фиброза (увеличение на 70 %). По данным американского открытого исследования у 22 больных с не реагировавшим на УДХК стойким повышением уровня ЩФ > 2-кратной верхней границы нормы, благоприятное действие добавления к терапии будесонида было минимальным, значительно повысился прогностический индекс Мейо и резко уменьшилась минеральная плотность костной ткани. Точное сравнение результатов затруднительно, т. к. в этой группе могут быть больные с далеко зашедшим ПБХ.
Опубликованы несколько метаанализов сетевых баз данных и ретроспективный анализ, цель которых — выяснить, оказывают ли при ПБХ благоприятное действие кортикостероиды и их добавление к УДХК-терапии. Ожидается окончательная оценка результатов рандомизированного сравнительного исследования III фазы с двойным слепым контролем сочетаний УДХК + будесонид и УДХК+ плацебо (European Clinical Trials Database [Eudra CT], № 2007- 004040-70).
Производные фиброевой кислоты (фибраты).
Фибраты оказывают мощное антихолестатическое действие за счет стимуляции рецепторов, активируемых пролифератором пероксисом (PPAR), и подавления некоторых путей синтеза желчных кислот. К применению этих препаратов при холестатических заболеваниях печени проявляется устойчивый интерес. Однако в некоторых странах ПБХ включен в число противопоказаний к приему фибратов, т. к. имеются сообщения об их гепатотоксичности.
В больших дозах фибраты угнетают активность некоторых цитохромных ферментов, в частности CYP2C9. Заслуживает внимание то, что CYP2C9 контролирует фармакокинетику нестероидных противовоспалительных средств и сочетать последние с большими дозами фибратов нельзя. В терапевтических дозах производные фиброевой кислоты повышают уровень АлАТ и АсАТ в сыворотке, очевидно, в связи с транскрипционным действием на синтез печеночных аминотрансфераз. Возможное повышение уровня креатинина в связи с его гиперпродукцией в мышцах вызывает опасения относительно нефротоксичности и требует настороженности и постоянного контроля. Кроме того, 5–10 % принимающих фибраты, особенно безафибрат, больных испытывают боль в мышцах и костях.
Первые исследования безафибрата (400 мг в сутки) как дополняющего УДХК средства сообщают о нормализации уровня ЩФ приблизительно у 45 % больных, ранее не ответивших на УДХК-терапию (vs приблизительно у 18 % получавших плацебо).
Более позднее проспективное рандомизированное контролируемое исследование без маскировки (27 больных, продолжительность терапии 100–120 мес.) показало значительное снижение уровня ЩФ и тенденцию к увеличению общей выживаемости у получавших комбинированную терапию УДХК + безафибрат (p = 0,057, лог-ранговый критерий).
Открытое исследование (28 больных) тоже продемонстрировало значительное ослабление тяжелого зуда при лечении безафибратом. У всех 12 больных, жаловавшихся на зуд до начала лечения, он исчез или уменьшился. Кроме того, у 20 и 24 пациентов, не ответивших на монотерапию УДХК, на фоне комбинированной терапии уровень ЩФ снизился более чем на 40 % за 6 и 12 мес. соответственно.
Предварительные исследования комбинированной терапии фенофибратом + УДХК тоже выявили снижение под ее влиянием уровня сывороточной ЩФ. По данным метаанализа, в целом частота полного биохимического ответа составила 69 %. По данным ретроспективного неконтролируемого исследования у 120 больных, не ответивших на монотерапию УДХК, при комбинированной терапии УДХК и фенофибратом в ближайшей перспективе у них наблюдалось улучшение и независимо от биохимических показателей увеличилась продолжительность периода до наступления печеночной недостаточности и необходимости ТП (p < 0,001).
Однако некоторые сомнения вызывает точность критериев отбора пациентов в исследование и ухудшение состояния не- которых из них с повышением уровня билирубина. Применение фибратов улучшает показатели суррогатных маркеров отдаленного прогноза, однако данные в его пользу ограничены исследованиями малых групп с короткими сроками наблюдения. Кроме того, во многих исследованиях первостепенные биохимические оцениваемые показатели четко не определены и только в единичных приняты стандартизованные критерии биохимического ответа.
Остается неясным, как влияют фибраты на прогрессирование фиброза. По одним данным, гистологическая картина улучшается, по другим — ухудшается. Кроме того, биохимическое улучшение под влиянием фибратов, по-видимому, не столь значительно, чтобы изменить уровень отдаленного риска смерти по связанным с заболеванием печени причинам или необходимости ТП, согласно оценке по шкале UK-PBC, а риск ухудшения функции почек, возможно, превосходит преимущества терапии. Метаанализ рандомизированных клинических исследований фактически не выявил значимых преимуществ дополнения терапии безафибратом по сравнению с монотерапией УДХК. Правда, в числе оцениваемых показателей этих исследований не было связанной с заболеванием печени смертности и необходимости ТП. Результаты клинического исследования III фазы применения безафибрата при ПБХ (NCT01654731) еще не опубликованы.
Рекомендации.
- Результаты рандомизированного клинического исследования применения при ПБХ будесонида (у больных без цирроза) и безафибрата (обоих в сочетании с УДХК) еще не опубликованы, в связи с чем рекомендаций по их терапевтическому применению EASL дать не может (II-2, 2).
Особые ситуации: беременность.
В большинстве случаев ПБХ диагностируют в немолодом возрасте, когда связанные с беременностью опасения неактуальны, но все же доля среди больных женщин детородного возраста достаточно весома. Иногда ПБХ и диагностируется в связи со стойкостью симптомов холестаза беременных и нарастанием зуда. В нечастых угрожающих жизни ситуациях, обычно обусловленных циррозом и портальной гипертензией, тактика ведения такая же, как вне беременности (эзофагогастроскопия при связанных с портальной гипертензией осложнениях, исключение аневризмы селезеночной артерии путем УЗИ и т. д.).
Опубликованный опыт ведения беременных с ПБХ ограничивается сериями случаев, но, по мнению экспертов, УДХК не представляет опасности в момент зачатия, во время беременности и в послеродовой период. Безопасным считают и применение холестирамина и, только в III триместре, рифампицина, хотя опубликованные данные по этому поводу ограниченны.
В отдельных случаях, при нестерпимом зуде беременных, может быть показан плазмаферез. При значительном холестазе необходима профилактика дефицита жирорастворимых витаминов. Возможно обострение холестаза после родов, в связи с чем в послеродовом периоде требуется наблюдение. Дозачаточное консультирование должно быть реалистичным и индивидуализированным.
По некоторым данным, холестаз усиливается в поздние сроки беременности и после родов, что может иметь катастрофические последствия, особенно при исходно дуктопеническом варианте ПБХ. Особый риск влечет за собой беременность и при портальной гипертензии, о чем следует информировать больных при консультировании. При циррозе любой этиологии сопутствующее беременности повышение портального давления предрасполагает к кровотечению из варикозно-расширенных вен пищевода. Для надлежащей оценки его риска и профилактики требуется плановая эндоскопия во II триместре беременности.
Рекомендации.
- Хотя в отсутствие цирроза беременность при ПБХ переносится хорошо, во II триместре всем больным показа- на консультация специалиста для определения тактики ведения. Прием УДХК во время беременности рекомендуется продолжать, хотя подтверждающих это данных в литературе немного. Сложный вопрос, требующий консультации специалиста, — ведение беременных с зудом. В III триместре, согласно экспертному мнению, можно для облегчения зуда назначать рифампицин (III, 1).
- При циррозе беременность связана с высоким риском осложнений у матери и плода. Больным в этой стадии ПБХ показано дозачаточное консультирование, а в случае наступления беременности — наблюдение специалиста (III, 1).
ПБХ с чертами аутоиммунного гепатита.
ПБХ сопровождается, в той или иной степени, воспалением паренхимы печени. При классическом варианте наблюдается только минимальный дольковый и «пограничный» гепатит, но у 8–10 % пациентов заболевание имеет черты аутоиммунного гепатита (АИГ). Этот вариант обозначают терминами «перекрестный синдром АИГ-ПБХ» или «ПБХ со вторичным АИГ».
Патогенез этого синдрома изучен слабо. Одни авторы рассматривают его как крайний вариант активности гепатита при ПБХ, другие — как отдельное заболевание. В настоящих рекомендациях основное внимание сосредоточено на идентификации больных с этим вариантом, т. к. при нем можно ожидать благоприятного действия сочетания УДХК с иммуносупрессивной терапией.
Определение и диагноз.
Обычно симптомы, характерные для ПБХ и АИГ, появляются одновременно, но в ряде случаев симптомы одного из них возникают раньше, чем другого (иногда — на несколько лет). При отсутствии у больного ПБХ достаточного ответа на 6–12-месячную терапию УДХК необходимо дополнительное обследование для выявления сопутствующего АИГ.
Вариант, при котором симптомы ПБХ и АИГ возникают одновременно.
Для определения ПБХ с чертами АИГ чаще всего пользуются Парижскими критериями, одобренными EASL.
**Согласно им, диагноз этого варианта ПБХ правомерен при соответствии хотя бы двум из следующих критериев: **
- уровень ЩФ, превышающий верхнюю границу нормы более чем в 2 раза, или ГГТ, превышающий верхнюю границу нормы более чем в 5 раз;
- титр АМА выше 1:40;
- выраженные изменения желчных протоков в биоптате.
И двум из следующих трех критериев:
- уровень ЩФ, превышающий верхнюю границу нормы более чем в 5 раз;
- уровень сывороточных IgG, превышающий верхнюю границу нормы более чем в 2 раза, или наличие анти- гладкомышечных аутоантител;
- гистологическая картина умеренного или тяжелого «пограничного» гепатита в биоптате.
В клинической практике биопсия печени в подобных случаях рассматривается как обязательная. Следует иметь в виду, что Парижские критерии диагностики каждого из заболеваний (ПБХ и АИГ) соответствуют их определениям. Критерии идентификации пациентов с воспалительным компонентом заболевания, которым показана кортикостероидная терапия, высоко- специфичны при умеренной чувствительности. Эти критерии совпадают с показаниями к терапии АИГ, сформулированными практическими рекомендациями AASLD. Большинство экспертов согласны с тем, что при соответствии Парижским критериям, особенно в отношении гистологических признаков активности «пограничного» гепатита, показано дополнение терапии иммуносупрессией.
Однако неясно, существует ли пороговый уровень, указывающий на возможность благоприятного действия иммуносупрессии. Это важно, т. к. согласно последним рекомендациям EASL по лечению АИГ, иммуносупрессия показана при относительно небольшом повышении уровня аминотрансфераз или IgG и умеренном индексе гистологи- ческой активности (≥ 4 из 18 пунктов). Для ретроспективной идентификации больных ПБХ, которым была показана кортикостероидная терапия, использовали пересмотренную шкалу АИГ и более позднюю упрощенную. Ни та, ни другая не пред- назначены для диагностики холестатического варианта АИГ или АИГ, сопутствующего ПБХ, следовательно, в клинической практике неприменимы. При сопутствующем ПБХ АИГ обнаруживаются ауто-антитела к растворимому антигену печени (SLA), пече- ночно-панкреатическому антигену (LP) и двунитевой ДНК.
Следовательно, при подозрении на сопутствующий АИГ больным ПБХ показано тестирование на аутоантитела.
Появление симптомов АИГ на фоне ранее диагностированного ПБХ.
Нарастание активности гепатита может произойти даже спустя годы после постановки диагноза ПБХ у больного, получающего УДХК. Для установления степени активности пограничного» гепатита в подобных случаях необходима биопсия печени.
Появление симптомов ПБХ на фоне ранее диагностированного АИГ.
При стойком повышении уровня печеночных ферментов по холестатическому типу при АИГ необходимо обследование для исключения ПБХ. Кроме того, ПБХ следует иметь в виду при дифференциальном диагнозе с АИГ, если на его фоне возникло повышение уровня печеночных ферментов по холестатическому типу с характерными для ПБХ симптомами (зудом, «сухим» синдромом). АМА могут обнаруживаться при остром гепатите, но обычно их титр со временем снижается, что следует иметь в виду при диагностике ПБХ на фоне уже существующего АИГ, так же как и то, что острый АИГ сопровождается значительным повреждением желчных протоков. Персистирование АМА при АИГ необязательно свидетельствует о поддающемся гистологическому подтверждению повреждении желчных протоков. Течение АИГ может не отличаться от такового в АМА-серонегативных случаях.
Лечение и прогноз при одновременном появлении симптомов ПБХ и АИГ или возникновении симптомов АИГ на фоне ПБХ.
Наличие характерных для АИГ симптомов ухудшает прогноз ПБХ и сопровождается более быстрым прогрессированием фиброза. Как уже сказано выше, гистологическая картина «пограничного» гепатита является предиктором прогрессирования ПБХ. Однако крупных продолжительных исследований прогноза при терапии УДХК и кортикостероидами или комбинированной иммуносупрессивной терапии не опубликовано. Контролируемых клинических исследований их эффективности не проводилось и, возможно, проводиться не будет.
ПБХ-компонент заболевания следует лечить УДХК в стандартных дозах. При полном соответствии Парижским критериям диагноза АИГ в момент постановки диагноза ПБХ или позднее благоприятное действие в ближайшей и среднесрочной перспективе может оказать, согласно опубликованным данным, дополнительная иммуносупрессия. При тяжелом «пограничном» гепатите, который является наиболее надежным маркером гепатитной активности, иммуносупрессия обязательна, т. к. исходя из данных прежних контролируемых исследований АИГ, его прогноз при более чем 5-кратно превышающем верхнюю границу нормы уровне аминотрансфераз и более чем 2-кратно — γ-глобулинов без лечения неблагоприятен.
Необходима иммуносупрессия и при умеренно выраженном «пограничном» гепатите. Насколько при ПБХ с проявлениями АИГ низкой активности оправдана иммуносупрессия, в последнее время рекомендуемая при изолированном малоактивном АИГ, неясно. В большинстве случаев при АИГ на фоне ПБХ назначают кортикостероиды (преднизолон или преднизон). Их эффективность не отличается от таковой при изолированном АИГ. Комбинированная терапия кортикостероидами и азатиоприном реже, чем при изолированном АИГ, сопровождается кумулятивным побочным действием кортикостероидов и при ПБХ с чертами АИГ высокоэффективна.
По-видимому, эта категория больных чаще отвечает на менее интенсивную иммуносупрессию и меньше реагирует на ее отмену, чем больные с изолированным АИГ. Важно помнить о побочном действии кортикостероидов, особенно на фоне холестатического поражения печени. При ремиссии кортикостероидная терапия должна быть отменена во избежание нежелательного побочного действия ее длительного применения. Необходимая продолжительность кортикостероидной терапии в каждом случае оценивается индивидуально.
Лечение и прогноз при возникновении симптомов ПБХ на фоне АИГ.
Насколько оправдано дополнительное назначение УДХК при возникновении на фоне АИГ серологических или гистологических проявлений ПБХ, неясно. Учитывая редкость побочного действия и возможность отдаленного благоприятного эффекта, с практической точки зрения дополнение терапии УДХК рационально, особенно у относительно молодых больных, у которых можно ожидать развития дуктопении и билиарного цирроза в недалеком будущем.
Области неопределенности.
В настоящее время существует несколько областей неопределенности относительно ведения больных с «пересекающимся» синдромом ПБХ и АИГ.
- Каковы приложимые в клинической практике уровни IgG (γ-глобулинов) и аминотрансфераз, при которых больным ПБХ требуется биопсия печени и последующая иммуносупрессия?
- При каком уровне активности гепатита (или суррогатных его маркеров) иммуносупрессия показана?
- Существует ли система балльной оценки, способная в условиях практики и при клинических исследованиях идентифицировать больных ПБХ и АИГ?
- Какая степень повреждения желчных протоков подтверждает диагноз ПБХ у больных АИГ и следует ли назначать этой категории больных УДХК дополнительно к иммуносупрессии?
Рекомендации.
- Проявления АИГ обнаруживаются приблизительно у 10 % больных ПБХ. В большинстве случаев они возникают одновременно с проявлениями ПБХ, но иногда — спустя годы после того, как диагностирован ПБХ. Для подтверждения сопутствующего АИГ обязательна биопсия. Она показана при непропорционально высоком уровне АлАТ и/или IgG (III, 1).
- При ПБХ с характерными для АИГ чертами благоприятное действие оказывает дополняющая УДХК иммуносупрес- сивная терапия. Она показана при выраженном «пограничном» гепатите. Показания к ней следует оценивать и при умеренном «пограничном» гепатите. Больных необ- ходимо информировать о возможном побочном действии иммуносупрессивной терапии (III, 2).
Терапия симптомов ПБХ и его внепеченочных проявлений.
Спектр симптомов ПБХ, резко ухудшающих качество жизни, весьма широк и включает кроме общеизвестных (зуд, сухость слизистых, утомляемость) такие, как боль в костях и животе, синдром «беспокойных ног». Пока подход к облегчению или устранению этих симптомов в каждой клинике или центре имеет свои особенности. Настоящие рекомендации направлены на его стандартизацию. После выявления симптомов путем опроса проводят количественную оценку влияния каждого из них на качество жизни, чтобы вынести полное суждение о степе- ни негативного влияния ПБХ на образ жизни больного. Для этого широко используют шкалу-опросник Ликерта, визуальные аналоговые шкалы (хорошо разработанные для оценки интенсивности зуда) и более сложные инструменты комплексной субъективной оценки симптомов пациентами, например многопрофильную шкалу оценки качества жизни PBC-40 QoL.
В терапии тягостных для больных симптомов исходят не из раз и навсегда выбранной схемы, а опираются на оценку ее эффективности в динамике. Кроме того, отмена терапии нередко приводит к рецидиву симптома, так что в большинстве случаев требуется длительное лечение. Самостоятельно справляться с негативным влиянием симптомов ПБХ на качество жизни пациентам в известной мере помогают группы поддержки (см. соответствующий раздел). Беспокоящие больных симптомы ПБХ обычно не коррелируют с его тяжестью и не ослабевают под влиянием УДХК или препарата второй линии (ОБХК).
Рекомендации.
- Оценка всех жалоб, в частности на зуд, сухость слизистых и утомляемость, обязательна. Хотя в терминальной стадии поражения печени тягостные симптомы ПБХ усиливаются, их выраженность не всегда соответствует стадии заболевания (III, 1).
Зуд.
Зуд — один из характерных холестатических симптомов ПБХ, очень тягостный для больных. Однако он наблюдается далеко не всегда и его отсутствие не противоречит диагнозу ПБХ.
Зуд может возникнуть в любой стадии заболевания и уменьшиться, несмотря на его прогрессирование. Особенно тяжелым он бывает при дуктопеническом варианте ПБХ. Противозудная терапия требует системного подхода, непрерывной оценки эффективности и возможного побочного действия. Доказательств положи- тельного влияния УДХК-терапии на зуд нет, а ОБХК в больших дозах может даже усиливать его. Поскольку ПБХ является фактором риска желчнокаменной болезни и нередко ею осложняется, необходимо исключить обструкцию желчных путей как причину зуда. В клинической практике это обычно не вызывает трудностей.
Приведем несколько практических рекомендаций.
-
Смягчающие средства и экстракт овсяной муки уменьшают сухость и раздражение кожи.
-
Несколько облегчает зуд холодная ванна или душ пе- ред сном, тогда как горячая или теплая — вызывают и усиливают его.
-
При привычных расчесах с экскориациями облегчение может принести психотерапия.
-
Необходимо исключить наличие сопутствующей аллергии, особенно у больных с гиперэозинофилией или IgE-аллергией.
Как противозудные препараты первой линии при ПБХ широко используют секвестранты желчных кислот, хотя данные в пользу их эффективности ограничены и они плохо переносятся из-за побочного действия (метеоризма и запора). Может облегчить зуд невсасывающаяся ионообменная смола холестирамин. Секвестранты желчных кислот ухудшают всасывание в тонкой кишке других лекарственных средств, в т. ч. УДХК и ОБХК, поэтому принимаются за 2–4 ч до или через 2–4 ч после них, о чем врачи и фармацевты должны предупреждать пациентов. Новый секвестрант колесевелам часто переносится лучше, но несмотря на сообщения о его благо- приятном действии и снижении уровня желчных кислот под его влиянием, недавнее плацебо-контролируемое испытание его эффективность не подтвердило.
Полезным препаратом второй линии является рифампицин, действующий, по-видимому, как агонист прегнан-X-рецептора. Рандомизированные плацебоконтролируемые испытания и данные мета- анализов подтвердили его эффективность при холестатическом зуде. Потенциальное побочное действие рифампицина (гепатотоксичность и гемолиз) требует регулярного контроля показателей сыворотки и крови при его применении. Кроме того, рифампицин влияет на метаболизм витамина K, что может, особенно на фоне желтухи, приводить к увеличению МНО. Антагонисты опиатных рецепторов для приема внутрь налтрексон и налмефен используют как препараты третьей линии, т. к. они уменьшают ощущение зуда. Во избежание реакции, подобной синдрому отмены опиатов, терапию налтрексоном начинают с низких доз.
Тем не менее при длительном приеме многие больные постоянно испытывают этот синдром или снижение порога восприятия боли. Эмпирически для облегчения холестатического зуда, особенно не поддающегося никакой терапии, используют селективные ингибиторы обратного захвата серотонина (СИОЗС), например сертралин, и габапентин. Предполагается, что СИОЗС действуют путем изменения концентрации нейромедиаторов в ЦНС. Опубликовано несколько сообщений об их эффективности, но только 1 плацебо-контролируемое исследование с малым числом участников. СИОЗС могут вызывать сухость слизистой рта, о чем следует предупреждать больных. Предполагают, что габапентин тоже может облегчать зуд за счет повышения порога ноцицепции, однако един- ственное небольшое плацебо-контролируемое исследование не подтвердило его благоприятного действия. Учитывая клинический опыт, оправданы дальнейшие исследования габапентина.
Антигистаминные препараты иногда оказывают неспецифическое противозудное действие, вероятно, за счет своих седативных свойств. Как самостоятельные противозудные средства они не рекомендуются, но иногда полезны как дополнительные. Методы физического удаления желчных кислот, такие как назобилиарный дренаж, молекулярная адсорбирующая рециркулирующая система, ультрафиолетовое облучение (УФО) не вышли из стадии эксперимента. Имеются сообщения об их благоприятном действии (описания случаев или серий случаев), но испытания, соответствующие правилам, не проводились. УФО-терапия доступнее, чем остальные перечисленные методы. Назобилиарный дренаж приносит лишь временное облегчение зуда. Его приходится повторять. Он технически сложен, тяжело переносится больными, может осложняться панкреатитом и используется только в специализированных центрах как крайняя мера облегчения не уступающего никаким лекарственным средствам мучительного зуда. ТП уменьшает тяжелый зуд эффективно и быстро, часто в ближайшие сутки. Стойкий и неустранимый никакими терапевтическими методами зуд — один из синдромов ПБХ, при котором, согласно современным рекомендациям, показана ТП.
Терапия холестатического зуда интенсивно исследуется. В настоящее время в стадии разработки находится несколько новых препаратов и методов. Ведутся испытания препаратов новых классов, в частности ингибиторов обратного захвата желчных кислот. Разрабатываются и испытываются препараты, прицельно действующие на сигнальный путь аутотаксинлизофосфатидная кислота, участие которого в патогенезе холестатического зуда недавно установлено. Вероятно, скоро появятся новые средства, но потребуется их оценка в клинических условиях.
Рекомендации.
- Поэтапный подход к терапии зуда. Тяжелый зуд может быть проявлением агрессивного дуктопенического варианта ПБХ, при котором прогноз неблагоприятен. Больных с подобным зудом следует направлять на консультацию в специализированные центры (III, 1).
- Исходя из наиболее благоприятного профиля безопасности, как средство первой линии, несмотря на некоторые его недостатки, рекомендуется назначать холестирамин, не упуская из вида профилактику его взаимодействия с другими препаратами, обусловленного анионсвязывающими свойствами (II-2, 1).
- Как антизудный препарат второй линии рекомендуется рифампицин в дозе 150–300 мг/сут с контролем биохимических показателей функции печени через 6 и 12 нед. от начала терапии и с последующим увеличением дозы, учитывая его потенциальную гепатотоксичность, и немедленной отменой, если она проявилась (II-2, 1).
Утомляемость.
На утомляемость жалуется более 50 % больных, в т. ч. 20 % — на выраженную, препятствующую нормальному образу жизни. Утомляемость имеет периферическую и центральную составляющие. Последняя сопровождается когнитивными расстройствами (ухудшением памяти и способности сосредоточиваться), которые могут быть ошибочно приняты за проявления печеночной энцефалопатии. Прямой зависимости между тяжестью ПБХ и утомляемостью нет, за исключением терминальной стадии заболевания, которая сопровождается утомляемостью всегда. Терапии УДХК или ОБХК утомляемость не уступает, а потому требует, подобно зуду, отдельной оценки и лечения. После ТП больные ПБХ обычно испытывают утомляемость постоянно, поэтому сама по себе тяжелая утомляемость показанием к ТП не является. Надлежащим образом спланированных исследований лечения утомляемости мало, со- ответственно, нет и стандартных рекомендаций по нему. Утомляемость при ПБХ, как и при других хронических заболеваниях, имеет сложную природу, и ее эффективное лечение возможно только при системном подходе, т. е. количественной оценке ее выраженности и влияния на качество жизни больного (например, с помощью опросника PBC-40 QoL), при выявлении факторов, которыми она обусловлена, и выработке стратегии их преодоления. Появились данные, указывающие на роль социальной изоляции, сопутствующей утомляемости, в ухудшении качества жизни больных и на необходимость помощи больным в ее преодолении. Применительно к утомляемости важное значение имеет выявление сопутствующих ПБХ заболеваний или методов его лечения, которые прямо или косвенно могут быть причинами утомляемости, в частности аутоиммунных заболеваний (гипотиреоза, аутоиммунной анемии), свойственных данной возрастной группе заболеваний (например, сахарного диабета 2-го типа) или заболеваний, терапия которых (например, гипотензивные препараты) способствует утомляемости. Провоцируют утомляемость ночной зуд, вегетативная дисфункция, обезвоживание, синдром «беспокойных ног», сопутствующая медикаментозная терапия (например, прием β-блокаторов). Данных, подтверждающих вредность физических упражнений для подверженных утомляемости больных ПБХ, в литературе нет. Наоборот, предварительные исследования указывают на благоприятное действие продуманной схемы физических упражнений, подходящих конкретному пациенту. Может быть полезен модафенил, но его применяют только в случаях, соответствующих критериям диагноза дневной сонливости.
Рекомендации.
- Обследование для выявления сопутствующих и альтернативных причин утомляемости, в частности анемии, гипотиреоза и расстройств сна (III, 1).
- Помощь больным с выраженной утомляемостью, которая сама по себе может быть инвалидизирующим фактором, в выработке собственных стратегий ее преодоления, в частности профилактики социальной изоляции, которая усугубляет утомляемость (III, 2).
Синдром Шегрена.
Сухость слизистой рта и/или конъюнктивы наблюдается при ПБХ часто, но скорее в виде отдельных жалоб, чем типичного синдрома Шегрена. Иногда он включает дисфагию и сухость слизистой влагалища. О наличии сухости слизистых следует спрашивать прицельно. Часто симптомы сухости облегчают «искусственные слезы» и «искусственная слюна». В более упорных случаях могут быть полезны пилокарпин или цевимелин (агонист мускариновых рецепторов). При выраженной ксеростомии важно тщательное соблюдение гигиены полости рта для профилактики кариеса. Кроме того, ксеростомия предрасполагает к кандидозу слизистой рта. Устранить сухость слизистой влагалища помогает безопасный в отношении гепатотоксичности крем с эстрогеном (его может назначить как гинеколог, так и врач общей практики). Более подробные рекомендации по лечению сухости слизистых и синдрома Шегрена представлены в источнике. Упорный синдром Шегрена может потребовать лечения методами, доступными только специалистам в соответствующих областях.
Рекомендации.
- Выраженные проявления сухости слизистых ухудшают качество жизни больных и требуют консультации специалистов в соответствующих областях (III, 1).
Ведение осложнений поражения печени.
Остеопороз.
Остеопороз — распространенное осложнение ПБХ. Риск его развития пока не установлен из-за неоднородности представленных в литературе данных по возрасту больных, тяжести ПБХ и степени холестаза. В качестве профилактики и лечения остеопороза рекомендуют полноценное питание и устранение факторов риска (отказ от курения, физические упражнения).
В отсутствие почечнокаменной болезни может быть показана дотация кальция и витамина D, особенно на фоне приема ионообменных смол, которые снижают всасывание витамина D в тонкой кишке. Ее применяют широко, хотя ее польза не подтверждена. Больным с нормальным нутритивным статусом и без нарушений всасывания кальция (подавления желудочной секреции соляной кислоты или синдрома нарушенного всасывания) его дотация не рекомендуется. Можно контролировать уровень витамина D. Единого мнения о том, когда следует начинать терапию остеопороза, нет. Представляется целесообразным ее назначение при T-критерии бедренной кости ниже.
Любое терапевтическое вмешательство оценивается с точки зрения его благоприятного влияния на уровень риска переломов костей. Уровень риска рассчитывают по рекомендованной ВОЗ шкале FRAX (пример расчета представлен на <http:// www.shef.ac.uk/FRAX/>).
По данным нескольких исследований, применение бисфосфонатов, в частности алендроната еженедельно и ибандроната ежемесячно, увеличивает костную массу у больных ПБХ. Увеличение костной массы после приема алендроната при ПБХ сравнимо с таковым при остеопорозе в постменопаузе. Азотсодержащие бисфосфонаты при приеме внутрь могут вызывать гастродуоденит и эзофагит. Их применение при пищеводном варикозе требует осторожности. В подобных случаях показаны бисфосфонаты для парентерального введения (памидронат, ибандронат или золедроновая кислота). У женщин в постменопаузе эффективна гормональная заместительная терапия. Полезным ориентиром в терапии служит оценка минеральной плотности костей (двухфотонная рентгеновская абсорбциометрия — ДРА), которую следует выполнить при постановке диагноза ПБХ и повторить через 1–5 лет в зависимости от ее результата и общего уровня риска остеопороза.
Рекомендации.
- Риск остеопороза следует иметь в виду у всех больных ПБХ (III, 1).
- Как часть оценки риска остеопороза следует определять минеральную плотность костей посредством ДРА при постановке диагноза ПБХ и повторять измерение позднее в зависимости от показаний (III, 1).
- Дотации кальция и витамина D при ПБХ назначаются в соответствии с местными рекомендациями (III, 2).
- Бисфосфонаты — эффективные и безопасные средства при связанном с ПБХ остеопорозе со значительным риском переломов костей. При варикозе пищевода и желудка их применение требует осторожности. Проводить терапию следует соответственно рекомендациям по лечению остеопороза (II-2, 1).
Возмещение дефицита жирорастворимых витаминов.
Холестаз и снижение секреции желчных кислот как его следствие ухудшают всасывание жиров, однако дефицит жирорастворимых витаминов (A, D, E и K) при ПБХ наблюдается редко. В большинстве случаев уровень 5-гидроксивитамина D и 1–25-дигидроксивитамина D в сыворотке при ПБХ нормальный. Снижен он только у больных с длительной желтухой и остеомаляцией и у кандидатов на ТП. У взрослых при холестазе всасывание жиров и жирорастворимых витаминов нарушается меньше, чем у детей. Следует считать ПБХ показанием к определению сывороточного уровня витамина D и других жирорастворимых витаминов и установить пороговый уровень, ниже которого, особенно при желтухе, требуется дотация этих витаминов.
Витамин K при тяжелом холестазе назначают профилактически перед инвазивными процедурами и в ситуациях кровотечения или его риска.
Рекомендации.
- При ПБХ, особенно сопровождающемся длительной желтухой, возможно нарушение всасывания жирорастворимых витаминов. Необходимость их дотации оценивается индивидуально (III, 2).
Гиперлипидемия.
Уровень липидов в сыворотке повышается приблизительно в 80 % случаев ПБХ. Механизм развития гиперлипидемии при ПБХ отличается от такового при других состояниях. В ранней стадии заболевания повышается уровень липопротеидов очень низкой плотности и ЛПНП, значительно — ЛПВП. По мере прогрессирования заболевания уровень ЛПНП продолжает повышаться, а ЛПВП — падает, хотя и остается выше, чем в норме. Уровень триглицеридов обычно нормален или слегка повышен. Избыток ЛПНП частично составляют антиатерогенные аномальные липопротеидные частицы (липопротеид X), богатые свободным холестерином и фосфолипидами. Имеет клиническое значение то, что повышается уровень холестерина ЛПВП, а не ЛПНП. Следовательно, риск смерти от осложнений атеросклероза при ПБХ не выше, чем при аналогичном уровне гиперлипидемии без ПБХ. Специального лечения гиперлипидемия, свя- занная с ПБХ, обычно не требует. Оно показано при сопутствующих классических факторах сердечно-сосудистого риска и проводится по обычным принципам. В спорных случаях показана оценка совместно со специалистом по гиперлипидемии.
Рекомендации.
- Гиперлипидемия характерна для холестаза, но доказательств повышения в связи с ней сердечно-сосудистого риска при ПБХ нет. При сопутствующем метаболическом синдроме (с высоким уровнем холестерина, низким — холестерина ЛПВП и высоким — ЛПНП) показания к назначению холестерин-понижающих препаратов оцениваются индивидуально. Противопоказанием к их применению ПБХ не является (III, 2).
Варикоз.
Портальная гипертензия при ПБХ, развившаяся как следствие билиарного цирроза, является неблаго- приятным прогностическим фактором. Изредка при ПБХ, в отличие от других хронических заболеваний печени, возможно ее развитие в ранней и предцирротической стадии вследствие узелковой регенеративной гиперплазии. Однако, по данным одного исследования, варикоз наблюдался у 6 % (8 из 127) больных с ранней стадией ПБХ. При этом 95 % больных с варикозом имели маркеры риска неблагоприятного течения ПБХ: мужской пол, гипоальбуминемия, повышение уровня билирубина и/или увеличение МНО. Это соответствует ранее опубликованным данным о принадлежности больных ПБХ с уровнем тромбоцитов ниже 140 × 109 /л и/или оценкой по шкале Мейо 4,5 и более к группе, которой показан эндоскопический скрининг.
По данным другого исследования, количество тромбоцитов менее 200 × 109 /л, уровень альбумина в сыворотке менее 4 г/дл и билирубина более 1,2 мг/дл служат независимыми факторами риска пищеводного варикоза, превышающего 90 %. Тактика ведения пищеводно-желудочного варикоза и кровотечения из варикозных узлов опирается на консенсусные рекомендации Baveno-VI, поход к диагностике варикоза, его лечению и профилактике кровотечений — на те же, что и при других хронических заболеваниях печени. Ориентиром служит показатель эластометрии более 20 кПа или тромбоцитопения менее 150 × 109 /л.
При больших варикозных узлах назначают неселективные β-блокаторы, как и при варикозе, связанном с циррозом иной этиологии. Следует, однако, иметь в виду, что они усиливают утомляемость. При варикозных узлах с высоким риском кровотечения рекомендуется их профилактическая эндоскопическое лигирование. Рекомендации Baveno-VI указывают, что выбор вмешательства зависит от наличия у специалистов клиники соответствующих навыков и имеющегося в их распоряжении оборудования. Рекомендации
Рекомендации.
- Baveno-VI по выявлению и ведению варикоза полностью применимы при ПБХ (III, 2).
Гепатоцеллюлярный рак (ГЦК)
Циррозу при ПБХ свойственны те же осложнения хронического поражения печени, что и циррозу почти любой этиологии. Одним из наиболее тяжелых является гепатоцеллюлярный рак (ГЦК). Частота его развития составляет около 0,36 случая на 100 человеко-лет. Далеко зашедшее поражение печени по данным биопсии указывает при ПБХ на высокий риск ГЦК. По данным недавно опубликованного многоцентрового длительного проспективного наблюдения 4565 больных ПБХ в Северной Америке и Европе, заболеваемость ГЦК составляет у них 3,4 на 1000 человеко-лет. Это исследование большого числа больных — жителей многих стран подтвердило значимость при ПБХ таких факторов риска ГЦР, как мужской пол и недостаточный ответ на УДХК-терапию. Более того, оно показало, что ГЦК у мужчин, не ответивших на УДХК-терапию, риск ГЦР в ранней стадии ПБХ выше, чем у отвечающих на УДХК женщин с ПБХ-циррозом, и тем самым подчеркнуло важность стратификации риска при ведении пациентов с ПБХ. Регулярный контроль посредством визуализации в поперечных сечениях с определением уровня α-фетопротеина или без него каждые 6 мес., как принято в настоящее время при циррозе, соот- ветствует рекомендациям EASL.
Рекомендации.
- Больным с предполагаемым диагнозом цирроза печени показано наблюдение в целях ранней диагностики ГЦК.
Трансплантация печени.
Значимость ПБХ как показания к ТП за последние десятилетия уменьшилась, хотя распространенность этого заболевания возросла. Трансплантация печени при ПБХ проводят по тем же показаниям, что и при других заболеваниях, однако подход к их оценке в разных клиниках и странах отличается.
ТП следует считать показанной при осложнениях цирроза, о тяжести которых свидетельствует оценка по соответствующим шкалам (например, 15 баллов и более по шкале MELD), прогрессирующей гипербилирубинемии выше 50–85 мкмоль/л (3–5 мг/дл), в отдельных случаях — при не уступающем медикаментозной терапии зуде. В большинстве случаев прогноз при ТП по поводу ПБХ благоприятный. 5-летняя выживаемость составляет 80–85 %, что выше, чем при ТП по поводу других заболеваний. Утомляемость после ТП часто сохраняется, и сама по себе утомляемость не рассматривается как показание к ТП.
Посттрансплантационное ведение соответствует текущим рекомендациям и учитывает риск остеопороза и аутоиммунных заболеваний, таких как аутоиммунный тиреоидит. Применение такролимуса сопровождается более частыми рецидивами ПБХ. Однако пока данных для рекомендации какой-либо схемы иммуносупрессии как предпочтительной недостаточно. Рецидив ПБХ после ТП, по опубликованным данным, наблюдается в среднем у 20 % больных, но частота гистологических рецидивов, по-видимому, выше. АМА после ТП сохраняются. Диагноз рецидива ПБХ после ТП требует гистологического подтверждения, т. к. уровень печеночных ферментов может оставаться нормальным.
К потере трансплантата рецидив ПБХ приводит редко и, по-видимому, на выживаемости реципиентов не сказывается. Следовательно, оснований рекомендовать биопсию как обязательную для ранней диагностики рецидива ПБХ у реципиентов печени нет. УДХК-терапия снижает уровень печеночных ферментов и, возможно, частоту рецидивов ПБХ , но данных в пользу ее обязательного назначения после ТП недостаточно. На практике УДХК считается показанной и обычно назначается при подозрении на рецидив ПБХ. Реципиенты печени должны также получать профилактику остеопороза.
Рекомендации.
- Показания к ТП следует оценивать при возникновении осложнений цирроза, наличии маркеров его тяжести (например, стойкой гипербилирубинемии 50 мкмоль/л, или 3 мг/ дл, либо оценке по MELD > 15 баллов) или упорно не уступающего медикаментозной терапии зуда. Внесение в лист ожидания ТП регулируется соответствующими местными (обычно в пределах страны) рекомендациями (II-2, 1).
- Применение УДХК при подтвержденном или предполагаемом рецидиве ПБХ у реципиентов печени безопасно и может улучшить биохимические показатели функции печени (II-2, 2).
Организация клинической помощи.
Появление возможностей индивидуализации терапии ПБХ (препаратов второй линии для больных, у которых не удается добиться полноценного ответа на УДХК, и препаратов, облегчающих отдельные симптомы) усложнило выбор терапевтической тактики и сделало актуальным вопрос о равном доступе пациентов к наиболее эффективному лечению. Модель «максимально доступной эффективности», учитывающая уровень риска прогрессирования и выраженность тягостных для больных симптомов и предполагающая оптимальный объем терапии без его не- оправданного расширения, должна быть гибкой и учитывать особенности организации помощи в разных странах. Помочь внедрить в практику эти и другие рекомендации поставила своей целью RARE-LIVER ERN (<http://ec.europa.eu/health/rare_diseases/european_reference_networks/erf_ en>). Кроме того, ERN создает краткие рекомендации по редким заболеваниям, в частности ПБХ, доступные больным на их родных языках. Рассматриваются следующие аспекты, приведенные ниже.
Пути оказания помощи.
Важную роль играют пути оказания помощи, т. е. практическое осуществление рекомендаций и создание удобной системы клинической оценки, распределение ответственности за оказание помощи при ПБХ. Природа заболевания и сопутствующие ей факторы риска таковы, что может потребоваться участие всех звеньев — от первичной врачебной помощи до специализированной и трансплантологической. Всем больным ПБХ требуется как минимум ежегодное контрольное обследование для оценки динамики проявлений заболевания и определение необходимого объема лечения. Предварительная работа показала, что эффективность по- мощи и степень удовлетворения пациентов возрастают, если они могут получить эту помощь в своих странах и регионах. Основная задача RARE-LIVER ERN — создание доступа к информации, облегчающей практическое осуществление рекомендаций на каждом его этапе.
Рекомендации
- Больным ПБХ требуется пожизненное наблюдение и выбор тактики ведения в соответствии с особенностями течения заболевания (III, 1).
- На основе настоящих рекомендаций необходимо разработать и принять пути оказания помощи больным ПБХ (III, 2).
Клинические стандарты помощи.
Для улучшения помощи в отдельных странах чрезвычайно важна оценка ее уровня. Общих стандартов помощи больным ПБХ, пригодных для разработки программ повышения ее качества, пока нет, поэтому особую роль приобретает создание общей концепции. На основе настоящих рекомендаций предлагается постепенное, с учетом практики и ресурсов каждой страны, введение следующих стандартов.
- УЗИ органов брюшной полости во всех случаях ПБХ на первом этапе обследования для исключения других причин холестаза (стандарт в 90 % случаев).
- Назначение во всех случаях ПБХ как препарата первой линии УДХК в дозе 13–15 мг/кг/сут (стандарт — применение препарата в указанной дозе или документирование непереносимости УДХК в 90 % случаев).
- Для облегчения идентификации больных с риском прогрессирования ПБХ необходимо оценивать и документировать биохимический ответ на 12-месячную УДХК-терапию (стандарт — регистрация ответа на УДХК с указанием критериев его оценки в 80 % случаев проведения терапии).
- Симптомы, ухудшающие качество жизни (в частности, зуд, сухость слизистых), требуют надлежащей диагностики и лечения (стандарт — регистрация наличия или отсутствия зуда, сухости слизистых и утомляемости в течение последнего года в 90 % случаев).
- Возможность своевременного рассмотрения показаний к ТП путем обсуждения с гепатологом-трансплантологом всех случаев ПБХ с гипербилирубинемией более 50 мкмоль/л (3 мг/дл) или проявлениями декомпенсации цирроза (кровотечением из варикозных узлов, асцитом, энцефалопатией) (стандарт — документирование показаний в ближайшие 3 мес. после соответствующего события и предпринятых на основании обсуждения действий в 90 % случаев).
- Оценка во всех случаях ПБХ риска остеопороза для надлежащей профилактики переломов. Наблюдение и лечение остеопороза проводятся согласно национальным рекомендациям (стандарт — оценка риска в первые 5 лет заболевания в 80 % случаев).
- Гарантирующая своевременное распознавание и лечение относительно редкого варианта ПБХ с чертами АИГ биопсия печени с квалифицированной клинико-гистологической оценкой в случае подозрения на него (стандарт — подтверждение биопсией и документирование ее клинико-гистологической оценки в 90 % случаев ПБХ с чертами АИГ).
Рекомендации.
- Для документирования и улучшения качества помощи больным ПБХ необходимы стандарты ее оценки (III, 2).
Психологическая поддержка больных.
Качественные исследования подтвердили, что информирование больных, последовательное создание конструктивного настроя, неоднократные объяснения в доступной для них форме помогают больным более спокойно принять диагноз ПБХ. Существует целый ряд групп и сайтов поддержки, о чем следует информировать больных.
Вот перечень европейских сайтов:
- Австрия: http://www.gesundeleber.at/
- ЕС: http://www.elpa-info.org/
- Франция: http://www.albi-france.org
- Германия: http://www.leberhilfe.org/
- Италия: http://www.fondazionefegato.it/
- Нидерланды: http://www.leverpatientenvereniging.nl
- Норвегия: https://www.fal.link/
- Испания: http://www.albi-espana.org/
- Великобритания: http://www.pbcfoundation.org.uk/
Особенно ухудшает, по собственным ощущениям больных, качество их жизни и социальные функции утомляемость. Возможности уменьшить социальную изоляцию и психологической поддержки больных ПБХ в литературе освещены слабо.
Существуют «телефоны помощи» и группы пациентов, оказывающих психологическую поддержку всем обратившимся к ним. Они помогают больным избежать социальной изоляции. Могут быть полезны психотерапевтические методы, например когнитивная поведенческая терапия. Эти способы поддержки показали себя действенными в облегчении психологического напряжения, связанного с постепенной утратой возможности продолжать обычный образ жизни.
Влияние утомляемости на качество жизни больных ПБХ изучалось с помощью полуструктурированных интервью и инструментов оценки психологических симптомов. Больные с сильной утомляемостью более чувствительны к эмоци- ональному перенапряжению и склонны считать, что ПБХ резко ухудшило качество их жизни. Пациентов, тяжело переживающих утомляемость, рекомендуется направлять к психологам. Часто эти больные нуждаются в дополнительной поддержке близких.
Рекомендации
- Больных ПБХ следует информировать о доступных группах и других путях психологической поддержки (III, 2).
Заключение.
ПБХ — распространенная причина холестаза, особенно у женщин старше 40 лет. Прогрессирование ПБХ приводит к терминальной стадии поражения печени, оценить риск которого до начала терапии и на ее фоне помогает ряд методов стратификации. ПБХ диагностируется на основании биохимических и серологических данных. УДХК показана во всех случаях, но ее эффективность требует взвешенной оценки. Во всех случаях необходима исходная и последующая (на фоне терапии) индивидуальная оценка риска прогрессирования на основании коррелирующих с ним и со стадией заболевания биохимических, серологических и визуализирующих маркеров.
При недостаточном ответе на УДХК-терапию в настоящее время доступны лицензированные (ОБХК) и некоторые вновь разработанные (или проходящие доработку и клинические испытания) препараты и средства, ранее для лечения ПБХ не применявшиеся. При клинически выраженном ПБХ необходимо постоянное наблюдение не только для предотвращения прогрессирования поражения печени, но и для облегчения тягостных симптомов (зуда, сухости слизистых, утомляемости).
Клинические рекомендации облегчают всесторонний подход к пожизненной терапии ПБХ. Необходима равная доступность современной помощи при этом заболевании во всех странах, качество которой должно оцениваться по единым стандартам.
Источник и списки литературы: EASL.





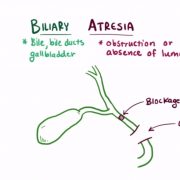

Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!