Индекс массы тела > 30 — не противопоказание для прижизненного донорства части печени
Прижизненное донорства фрагмента печени применяется в случаях трансплантации печени детям и взрослым, когда нет подходящего органа от посмертного донора. К примеру, в России большинство трансплантаций печени детям происходит от живого родственного донора. В статье пойдёт речь о том, что избыточная масса тела не всегда является противопоказанием для прижизненного донорства части печени.
Данная статья — клиническое исследование, и не является клиническим руководством или рекомендацией.
Вступление.
Содержание статьи:
Развитие трансплантации печени привело к постоянному дефициту органов от посмертных доноров. Во многих странах 20-30% пациентов в очереди на трансплантацию печени будут умирать из-за отсутствия подходящего органа.
Трансплантация печени от живого донора увеличивает пул доноров и снижает смертность в листе ожидания органа. Так, к примеру, в Торонто, прижизненное донорство фрагмента печени, стало неотъемлемой частью программы по трансплантации печени, и, с 2000 года выполнено около 600 трансплантаций печени.
В России, ведущим центром по трансплантации печени является Научный Центр Трансплантологии и Искусственных органов имени В. И. Шумакова, где ежегодно выполняется 160-180 трансплантаций печени, около половины из которых выполнены за счёт прижизненного донорства фрагментов печени. В Российской федерации прижизненное донорство фрагмента печени возможно только от кровных родственников реципиента.
Ожирение и прижизненное донорство фрагмента печени.
За последние 3 десятилетия показатели ожирения резко возросли во всем мире. В Соединенных Штатах в 2012 году 69% населения имели избыточный вес (индекс массы тела > 25) и 35% страдали ожирением (индекс массы тела > 30). Ожирение было идентифицировано как сильный фактор риска стеатоза печени, наблюдаемый при биопсии у 76% потенциальных прижизненных доноров печени с ИМТ > 28.
Стеатоз трансплантата при трансплантации печени является плохим прогностическим фактором по исходу трансплантации печени наряду с такими факторами, как ишемия трансплантата, реперфузионное повреждение, билиарные осложнения, сосудистые осложнения, и может снизить выживаемость пациентов.
В результате увеличения ожирения в Северной Америке, пул потенциальных прижизненных доноров в настоящее время наполняется донорами с ИМТ> 30 кг, многие из которых имеют> 10% стеатоза печени по данным биопсии. Во многих центрах трансплантации, доноры, у которых уровень стеатоза печени по данным биопсии >10%, исключаются, и не могут быть донорами. И приходится «кондиционироваться» — соблюдать специальный режим питания для доноров, а затем повторно проходить биопсию печени.
В настоящем исследовании авторы решили проверить, возможно ли делать трансплантацию печени от доноров с индексом массы тела более 30, но равное или менее 35, при этом, доноров процент стеатоза печени не должен был превышать 10%, а так же у таких потенциальных доноров должны были отсутствовать другие сопутствующие заболевания, связанные с ожирением, таких как: диабет, дислипидемия и гипертония.
Материалы и методы.
Авторы провели ретроспективный когортный анализ всех пациентов, которым была проведена трансплантация правой доли печени от живого донора в период с апреля 2000 года по май 2014 года в больнице Торонто в Университете Торонто. Это исследование было одобрено Советом по этике исследований Сети здравоохранения Университета в Торонто.
Донор должен соответствовать определённым критериям:
- Возраст доноров должен составлять от 18 до 60 лет;
- Все донации являются добровольными и альтруистическими;
- Все доноры должны предоставлять информированное согласие на донацию;
- Все потенциальные доноры должны иметь хорошее здоровье, и поэтому все пациенты с сердечно-сосудистыми сопутствующими заболеваниями, включая диабет, дислипидемию и гипертонию, исключаются из донорства;
- Пациенты с ИМТ> 35 кг не считаются кандидатами на прижизненное донорство органов.
Потенциальные живые доноры проходят комплексное обследование, которое включает в себя обычные анализы крови, вирусные серологические исследования и инструментальные методы (УЗИ, КТ и МРТ). Кандидаты также проходят медицинскую и психиатрическую экспертизу специалистами здравоохранения.
Всем отобранным кандидатам выполнялась биопсия печени. Также в исследование были включены кандидаты с ИМТ от 30 до 35 кг, им также выполнялась биопсия печени, чтобы исключить жировую дистрофию печени.
Все потенциальные доноры, у кого процент жировой дистрофии (крупно- или мелко-капельной) составил > 10%, независимо от их ИМТ, были исключены из программы донорства, и, соответственно, из этого исследования.
Реципиенты, получившие трансплантат от донора с избыточным весом, сравнивались с реципиентами, получивших свой трансплантат от доноров, не страдавших ожирением (ИМТ <30) в течение того же периода времени.
Характеристики доноров и реципиентов.
Следующие данные доноров были собраны из базы данных для анализа: возраст, пол и ИМТ.
Также были собраны данные реципиента: возраст, пол, ИМТ, этиологию заболевания печени, показания к трансплантации печени, оценка печеночной недостаточности (MELD).
Все резекции печени у доноров выполнялись открытым способом.
Интраоперационные данные.
У реципиентов оценивались следующие показатели: кровопотеря, тип билиарной реконструкции, также оценивался коэффициент размера трансплантата с весом реципиента (GRWR), время холодовой ишемии трансплантата, время тепловой ишемии. Стоит отметить, что билиодигестивный анастомоз накладывался пациентам, страдающим первичным склерозирующим холангитом или в случае, когда у трансплантата было несколько желчных протоков. Остальным пациентам накладывался концевой анастомоз холедох-холедох.
Послеоперационные данные.
После трансплантации у всех реципиентов отслеживались следующие лабораторные показатели: АСТ, АЛТ, уровень билирубина в течение первых 7 послеоперационных суток. Также отслеживались кровотоки трансплантата при помощи УЗДГ.
У доноров и реципиентов также оценивалось время пребывания в отделении реанимации, общее количество койко-дней, а также уровень послеоперационных осложнений в течение первых 30 дней после операции, а также 30-дневной смертности.
Шкала Clavien-Dindo была использована для определения тяжести осложнений. Серьезные послеоперационные осложнения были определены как Dindo-Clavien 3b или выше. Доноры и реципиенты после выписки наблюдались амбулаторно через 1, 3 и 6 месяцев после выписки.
Результаты.
В период с апреля 2000 года по май 2014 года выполнено 469 трансплантаций правой доли от живого донора. Среди них 105 пациентоа (22%) получили трансплантат от доноров с ИМТ >30 но менее 35 (группа ИМТ > 30). 364 пациентов (78%) получили трансплантат от доноров с ИМТ <30 кг (Группа ИМТ <30).
Предоперационные характеристики реципиентов.
Характеристики реципиентов, такие как возраст, ИМТ, тяжесть по MELD и предоперационные биохимические показатели, калориметрические параметры были одинаковыми между обеими группами. Мужчины-реципиенты чаще встречались в группе ИМТ <30 по сравнению с группой ИМТ > 30. Не было существенной количественной разницы в распространенности гепатоцеллюлярной карциномы, цирроза в исходе гепатита С , фульминантной печеночной недостаточности в качестве показаний к трансплантации печени между обеими группами.
Характеристики доноров и трансплантатов печени.
В то время как средний возраст доноров был одинаковым между группами ИМТ <30 и ИМТ >30, доноры мужского пола чаще встречался в группе доноров с ожирением (ИМТ 30) (см. таблицу). Как и ожидалось, средний ИМТ доноров был значительно выше в группе ИМТ > 30 по сравнению с группой ИМТ <30 (ИМТ <30 = 24 ± 3 против ИМТ >30 = 33 ± 2, р = 0,0001).
|
|
Группа имт <30
кол-во=364
|
Группа имт 30-35
кол-во=105
|
p |
| Возраст донора, лет | 37 (±12) | 37 (±11) | 0.808 |
| Доноры мужского пола | 154 (42) | 67 (64) | 0.0001 |
| ИМТ доноров | 24 (±3) | 33 (±2) | 0.0001 |
| Время холодновой ишемии (мин.) | 99 (±66) | 79 (±36) | 0.013 |
| Время тепловой ишемии (мин.) | 51 (±18) | 50 (±17) | 0.681 |
| GRWR | 1.17 (±0.31) | 1.42 (±0.44) | 0.0001 |
| Трансплантаты со срединной веной (%) | 110 (30) | 30 (29) | 0.809 |
| Количество вен трансплантата | 2 (1-5) | 2 (1-4) | 0.48 |
| Билиодегистивный анастомоз (%) | 189 (52) | 60 (57) | 0.37 |
| Количество протоков трансплантата | 1 (1-3) | 1 (1-3) | 0.818 |
| Трансплантаты с количеством протоков > 2 | 134 (37) | 37 (35) | 0.818 |
| Индукционная иммуносупрессия (%) | 283 (78) | 84 (80) | 0.688 |
| Индукция Симулектом (%) | 201 (55) | 61 (58) | 0.656 |
| Индукция Тимоглобулином (%) | 82 (23) | 23 (22) | 1 |
| Такролимус (%) | 293 (80) | 84 (80) | 0.89 |
| Циклоспорин (%) | 111 (30) | 34 (32) | 0.72 |
| Микофенолаты (%) | 158 (43) | 54 (51) | 0.15 |
GRWR был значительно выше в группе ИМТ > 30 (ИМТ <30 = 1,17 ± 0,31 против ИМТ > 30 = 1,42 ± 0,44, p = 0,0001). Как описано в таблице, срединная печеночная вена была включена в 30% трансплантатов из группы ИМТ <30 и в 29% графтов в группе с ожирением у доноров (p = 0,8).
В то время как среднее число желчных протоков, подлежащих реконструкции в обеих группах, составляло 1 на трансплантацию, 37% и 35% трансплантатов в группах ИМТ <30 и ИМТ > 30, соответственно имели 2 желчных протока для реконструкции.
Характеристики реципиентов.
Ковопотеря в обех группах реципиентов была примерна одинакова (ИМТ <30: 2866 ± 2858 мл против ИМТ > 30: 2543 ± 2057 мл; p = 0,92). Интересно, что, несмотря на то, что время холодовой ишемии было значительно выше в группе доноров с ИМТ <30 кг, время тепловой ишемии не отличалося между обеими группами (см. табл.). Реконструкция желчных протоков с помощью билиодигестивного анастомоза была сопоставимой между группами обеими группами (см. таблицу).
Данные доноров после резекции печени.
Все показатели, оцениваемые у доноров, не отличались в обеих группах.
|
|
Доноры ИМТ <30
кол-во=364
|
Доноры ИМТ 30-35
кол-во=105
|
p |
| АСТ максимально первые 48 ч. (U/L) | 358 (±278) | 339 (±179) | 0.78 |
| АЛТ максимально первые 48 ч. (U/L) | 349 (±247) | 359 (±176) | 0.066 |
| АСТ на 7 день (U/L) | 69 (±38) | 73 (±35) | 0.171 |
| АЛТ на 7 день (U/L) | 98 (±48) | 99 (±41) | 0.619 |
| Билирубин максимально (mmol/L) | 46 (±25) | 51 (±29) | 0.14 |
| Билирубин на 7 день (U/L) | 25 (±20) | 32 (±23) | 0.02 |
| МНО максимально | 1.60 (±0.54) | 1.52 (±0.54) | 0.023 |
| МНО на 7 день | 1 (±0.31) | 0.99 (±0.31) | 0.78 |
| Нахождение в реанимации, дней | 0 (0-3) | 0 | 0.591 |
| Койко-дни | 6 (4-17) | 6 (4-15) | 0.138 |
| Осложнения у доноров | 46 (13) | 11 (10) | 0.615 |
| Осложнения у доноров через 30 дней | 41 (11) | 11 (10) | 1 |
| Раневая инфекция у донора | 7 (2) | 2 (2) | 0.99 |
| Грыжи у доноров | 6 (2) | 1 (1) | 0.604 |
| Тромбоз глубоких вен/ ТЭЛА | 6 (2) | 1 (1) | 0.604 |
| Пневмония у доноров | 3 (1) | 0 | 0.35 |
| Осложнения 3b и выше по Clavien | 8 (2) | 3 (3) | 0.71 |
| Поздние осложнения | 5 (1) | 1 (1) | 1 |
Не наблюдалось никаких различий между пациентами с ИМТ <30 по сравнению с пациентами с ИМТ > 30 в отношении послеоперационного максимума уровня АСТ, АЛТ и щелочной фосфатазы в сыворотке. Однако более низкий уровень билирубина в сыворотке на 7-й день наблюдались в группе ИМТ <30 (25 ± 20).
Напротив, более высокие пиковые послеоперационные уровни МНО присутствовали в группе ИМТ <30 (см. таблицу). Только один донор в группе ИМТ <30 требовал ухода в ОРИТ после операции. Кроме того, средняя продолжительность общего послеоперационного пребывания в больнице была одинаковой между группами ИМТ <30 и ИМТ > 30 (см. таблицу).
В то время как у 46 (14%) доноров было одно осложнение в группе ИМТ <30 в течение всего последующего наблюдения, только 11 (10%) доноров страдали осложнением в группе ИМТ > 30 (p = 0,61). Аналогичным образом, основных осложнений (Clavien-Dindo 3b и выше), которые произошли в течение первых 30 дней после операции, были очень мало, и они были сопоставимыми между обеими группами (2% в ИМТ <30) против 3% в группе ИМТ > 30; p = 0,71).
Отсроченные осложнения были сходными между обоими группами (см. таблицу). Смертей доноров не было.
Ранние послеоперационные результаты у реципиентов.
Как показано в таблице ниже, не было различий между обеими группами в отношении бактериальных инфекций и эпизодов пневмонии в течение первых 30 дней после трансплантации. Количество тромбозов печеночной артерии и портальной вены также отличалось несущественно. Тридцатидневная смертность после трансплантации не отличалась между группами ИМТ <30 и ИМТ > 30 (2% против 3% соответственно, р = 0,71). Среднее время пребывания в ОРИТ и количество койко-дней после трансплантации также были сходными между группами (см. таблицу ниже).
|
Доноры ИМТ <30
кол-во=364
|
Доноры ИМТ 30-35
кол-во=105
|
p | |
| АСТ максимально (U/L) | 583 (±725) | 688 (±698) | 0.29 |
| АЛТ максимально(U/L) | 465 (±422) | 571 (±530) | 0.011 |
| МНО максимально | 2.57 (±1.09) | 2.54 (±1.39) | 0.236 |
| Билирубин максимально peak (mmol/L) | 159 (±171) | 137 (±137) | 0.074 |
| ЩФ максимально | 192 (±196) | 203 (±166) | 0.77 |
| Снижение МНО (7 день) | 0.52 (±1.27) | 0.47 (±0.76) | 0.52 |
| Снижение билирубина (7 день) (mmol/L) | 19 (±131) | 17 (±118) | 0.827 |
| Осложнения в первые 30 дней (%) | 161 (44) | 32 (30) | 0.013 |
| Осложнения 3b и выше по Clavien (%) | 92 (25) | 21 (20) | 0.301 |
| Бактериальные осложнения в первые 30 дней (%) | 82 (22) | 82 (22) | 0.177 |
| Пневмония в первые 30 дней (%) | 17 (5) | 4 (4) | 1 |
| Тромбоз артерии (%) | 13 (4) | 1 (1) | 0.209 |
| Тромбоз воротной вены (%) | 9 (2) | 4 (4) | 0.5 |
| Смертность в первые 30 дней (%) | 8 (2) | 3 (3) | 0.716 |
| Пребывание в ОРИТ, дней | 1 (0-159) | 2 (0-78) | 0.46 |
| Койко-дни | 13 (1-260) | 11 (3-161) | 0.177 |
| Билиарные осложнения (%) | 92 (25) | 21 (20) | 0.301 |
| Билиарные осложнения в течение первого года (%) | 71 (19) | 19 (18) | 0.88 |
| Стриктуры желчных протоков (%) | 59 (16) | 13 (12) | 0.44 |
| Желчеистечение (%) | 39 (11) | 10 (9) | 0.857 |
| Отторжение трансплантата в первый год (%) | 59 (16) | 11 (10) | 0.16 |
| Рецидив гепатита С(%) | 20 (5) | 6 (5) | 1 |
| Рецидив ГЦК (%) | 10 (3) | 5 (5) | 0.34 |
| Ретрансплантации (%) | 19 (5) | 5 (5) | 1 |
| Ретрансплантации в течение 1 года (%) | 7 (2) | 3 (3) | 0.7 |
| Время наблюдения (месяцы) | 66 (0-173) | 51 (0-168) | 0.114 |
| 1-/5-/10-годовая выживаемость трансплантата (%) | 91/81/70 | 87/75/61 | 0.121 |
| 1-/5-/10-годовая выживаемость пациента (%) | 93/83/76 | 90/78/67 | 0.125 |
Отдалённые послеоперационные результаты у реципиентов.
Общая распространенность желчных осложнений во всей серии составила 24%. Не было обнаружено различий в частоте билиарных осложнений между обеими группами (см. таблицу выше).
Точно так же не было обнаружено различий в зависимости от типа осложнения (стриктура желчных протоков или желчеистечение) (см. таблицу выше).
Частота дисфункций трансплантата в течение первого года после трансплантации была аналогичным между обоими группами. Аналогично, рецидивы HCV и ГЦК после трансплантации, также были сходными между обеими группами (см. таблицу выше).
Количество ретрансплантаций в обих группах также не различалось. Выживаемость также была сходной между обеими группами (р = 0,12) (рисунок 1).
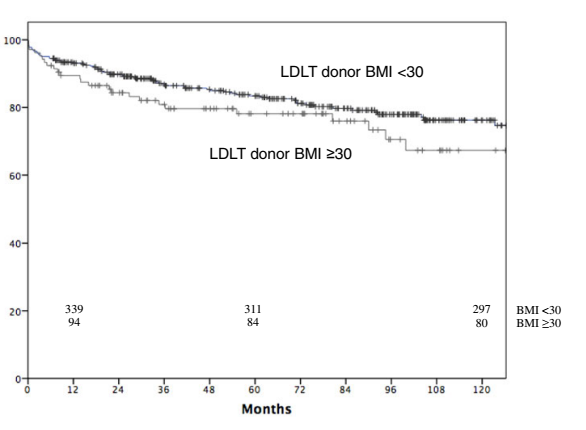
Рисунок 1.
Аналогичным образом, не было обнаружено различий в 1-5-10-летней выживаемости пациентов между группами (рисунок 2).
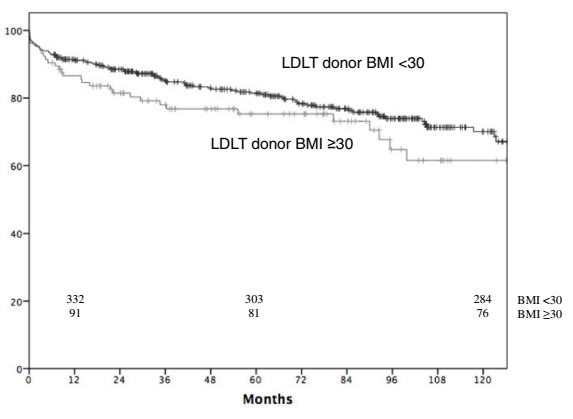
Рисунок 2.
Обсуждения.
В текущем исследовании авторы демонстрируют, что хорошо отобранные живые доноры с ИМТ от 30 до 35 без признаков стеатоза печени, и отсутствием сопутствующих заболеваний, включая гипертонию, диабет и дислипидемию, могут быть безопасно для здоровья и жизни прооперированы (правосторонняя гемигепатэктомия). Краткосрочные и долгосрочные результаты доноров с ИМТ> 30 и их реципиентов аналогичны донорам с ИМТ <30.
Ожирение является известным фактором риска послеоперационных осложнений, в том числе более высокий уровень легочной, раневой инфекции, и тромбозов. Кроме того, продолжительность пребывания в больнице увеличивается у пациентов с ожирением, а общие затраты на лечение значительно выше.
Наше исследование показало, что при условии качественного отбора доноров с ИМТ более 30, результаты трансплантации печени не отличаются по сравнению с донорами, чей ИМТ был ниже 30. Тем не менее, большинство центров трансплантации неохотно оперирует пациентов с ожирением в качестве живых доноров фрагмента печени даже при отсутствие печеночного стеатоза. При анализе базы данных A2ALL только у 15% всех живых доноров был ИМТ 30 со средним ИМТ 26 ± 5.
Данное наблюдение показало, что умеренно тучные пациенты без стеатоза печени и других сопутствующих заболеваний могут безопасно пройти донацию фрагмента печени.
Авторы исследовали 6336 пациентов, которым выполнялись абдоминальные операции. У 26% из этих пациентов было ожирение. Показатели осложнений у «здоровых» пациентов с ожирением с ИМТ> 30 были схожи с результатами тех, кто не страдал ожирением. По результатам анализа, ожирение не было приравнено к фактору операционного риска.
Также авторы проанализировали прочие исследования живых доноров фрагмента печени, где результат был схожим. Ito и соавторы сравнили послеоперационные осложнения у живых доноров печени с ИМТ > 25 и < 25. Различий не было обнаружено в обеих группах.
Iida и соавторы проанализировали более крупную когорту живых доноров (более 1300 доноров). В их анализе авторы не обнаружили никакой корреляции между ИМТ доноров и сравниваемыми осложнениями. ИМТ доноров в этом исследовании, как правило, были меньше, чем распределение среди взрослых в Северной Америке, и влияние ИМТ доноров на послеоперационные осложнения или пребывание в больнице не сообщалось.
Единственным исследованием в Северной Америке, которое было специально рассмотрено, было исследование Мосса и соавт. Авторы сравнили в небольшой серии результаты 16 живых доноров с ИМТ> 30 с 52 донорами с ИМТ <30. Авторы сообщили об увеличенном распространении раневых инфекций у доноров с ИМТ> 30. Все другие осложнения, в том числе венозный тромбоз, пневмония и дисфункция печени, а также общие показатели осложнений были сходными между группами пациентов. К сожалению,
малый размер выборки этой серии не позволил сделать твердые выводы, как это определено статистическим анализом.
Текущее исследование имеет несколько преимуществ.
Это крупнейшее исследование, где целенаправленно проанализированы доноры с ожирением и все возможные риски и осложнения. Результаты показывают, что ожирение само по себе, в отсутствие стеатоза или других сопутствующих заболеваний, не связано с послеоперационными осложнениями как у доноров, так и у реципиентов. Несмотря на то, что авторы отмечали более высокий пик сывороточного билирубина после операции у доноров с ИМТ > 30 по сравнению с группой ИМТ <30 (32 ± 23 против 25 ± 20 mmol/l; p = 0,02), пик МНО сыворотки показал противоположную тенденцию между обеими группами (1,6 ± 0,59 в группе ИМТ <30 против 1,52 ± 0,54 в группе ИМТ > 30, p = 0,023). Различный характер этих двух результатов в сочетании с небольшими абсолютными различиями между группами не приводит к каким-либо значимым клиническим выводам.
Данное исследование имеет некоторые ограничения.
Структура ретроспективного исследования и выбор смещения, присущие нерандомизированному исследованию, могут приводить к смешению факторов, благоприятствующих исходу у пациентов с ожирением. Например, не вся информация о пациенте была собрана для потенциальных доноров, страдающих ожирением, которые были исключены из донорства по медицинским показаниям. Это имеет потенциальные последствия для интерпретируемости результатов исследования, поскольку авторы не могут предсказать, каковы были бы результаты этих пациентов, если бы они стали донорами.
Поэтому авторы постарались компенсировать этот недостаток. Авторы подобрали однородную популяцию пациентов. Кроме того, гемигепатэктомия и трансплантация печени от живого донора выполнялись одной и той же хирургической бригадой по одному и тому же протоколу.
Также исследование проводилось в современную эпоху трансплантации печени. Авторы признают, что ИМТ является неспецифическим фактором, влияющим на осложнения, поскольку это показатель избыточного веса, а не избыточного жира. Такие факторы, как возраст, пол, этническая принадлежность и мышечная масса, могут влиять на соотношение между ИМТ и жировым отложениями.
Кроме того, ИМТ не проводит различия между избыточной жировой, мышечной или костной массой, а также не указывает на распределение жира в теле. Поэтому разумно рассматривать все эти параметры при оценке доноров.
В отсутствие других стандарных методов для точного количественного определения стеатоза печени, всем донорам выполнялась биопсия печени. Другие неинвазивные методы, включая визуализацию с помощью МР-спектроскопии или метода «Фиброскан» еще не проверены для точной оценки стеатоза печени и поэтому не могут быть использована для выставления противопоказаний к донорству.
Таким образом, должна проводиться только комплексная оценка доноров. Исключительно лишний вес не является противопоказанием к донорству фрагмента печени.
Авторский коллектив: Knaak M, Goldaracena N, Doyle A, Cattral MS, Greig PD, Lilly L, McGilvray ID, Levy GA, Ghanekar A, Renner EL, Grant DR, Selzner M, Selzner N.
Оригинальная статья была опубликована в журнале «American Journal of Transplantation» и доступна по ссылке: https://www.researchgate.net/publication/306382312
Перевод: Сёмаш Константин Олесьевич.





Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!