Трансплантация органов от доноров с гепатитом В: это безопасно? Этично ли это?
Центры пересадки печени по всему миру сталкиваются с огромным дефицитом органов для пациентов в листе ожидания. Рассматриваются различные типы инноваций для расширения этого пула доноров. В данной статье рассмотрен вопрос трансплантации органов от доноров с гепатитом В.
Введение
Содержание статьи:
Трансплантация печени является окончательным методом лечения прогрессирующих или декомпенсированных заболеваний печени. Трансплантация дает пациентам разумные шансы улучшить качество их жизни, а также возможность снова стать полноценными членами общества.
По данным UNOS за прошлый год выполнен 8082 операции по пересадке печени. 367 из них были родственными трансплантациями, а в остальных случаях использовались органы от посмертных доноров.
В то же время, в листе ожидания печени по данным UNOS находится 14232 человека. За последние 10 лет количество донаций оставалось низким. В 2017 году около 10% пациентов в листе ожидания были исключены, поскольку они стали слишком тяжелыми по соматическому статусу для выполнения трансплантации. Еще 10% умерли, ожидая появления органа.
Программы трансплантации во всех клиниках рассматривают новаторские способы увеличения пула донорских органов. Более активно стала проводится трансплантация фрагментов печени от живых доноров, также используется SPLIT-трансплантация печени от посмертного донора. Однако этих мер остаётся недостаточно, поэтому приходится увеличивать пул доноров за счёт расширенных критериев.
Так, например, в последние годы в мире практикуют изъятие печени у пациентов после сердечной смерти, печени с жировой дистрофией, органы доноров старше 50 лет.
Также, используют «потенциально опасные» органы — у доноров подозрением на HBV и HCV. К таким донорам относят «инъекционных» наркоманов, гомосексуалистов, людей с беспорядочными половыми связями, работников секс индустрии, а так же людей, имевших половые контакты с зараженными вирусными гепатитами и ВИЧ за последние 12 месяцев.
В некоторых случаях трансплантацию печени проводят от доноров с положительным маркёром антител к гепатиту B (анти-HBc +). Такие органы использовались для ортотопической трансплантации печени с начала программ трансплантации печени, и считались органами с высоким риском. Положительный анти-HBs может свидетельствовать о прошлом воздействии инфекции HBV, ранней или разрешающей инфекции (если IgM положительный). В некоторых случаях он представляет собой ложноположительную реакцию антител. У реципиентов на фоне приёма препаратов иммуносупрессии может в последствии выявляться HBsAg.
Однако в эпоху аналогов нуклеозидов в сочетании с анти-B иммуноглобулином, заболеваемость гепатитом В de novo снизилась, а выживаемость трансплантата и реципиентов сравнялась с результатами трансплантации печени от «здоровых доноров».
Таблица 1. Интерпретация различных серологических маркёров HBV.
| HBV маркёр | Интерпретация |
|---|---|
| HBsAg | Текущая инфекция (острая или хроническая). |
| Anti-HBc | IgM указывает на острую инфекцию или реактивацию IgG гепатита В. |
| Anti-HBs | Показатель прошедшей инфекции или иммунизации. |
| HBeAg | Указывает на активную репликацию вируса (репликативная стадия). |
| Anti-HBe | Нерепликативная стадия или хроническая инфекция HBV. |
Доноры с положительным Anti-HBs антигеном.
Во всем мире насчитывается около 257 миллионов человек, хронически инфицированных гепатитом B (определяется как положительный HBsAg). Сообщалось, что в США распространенность инфекции HBV составляла 0,4% (приблизительно 800 000 жителей США). Исследования NHANES (National Health and Nutrition Examination Survey) свидетельствуют о том, что распространенность HBsAg-положительных пациентов в США составляет 0,30%.
По данным UNOS доля анти-HBc + органов была увеличена с 1,8% с 1994 года до 6% к 2006 году (рисунок 1).
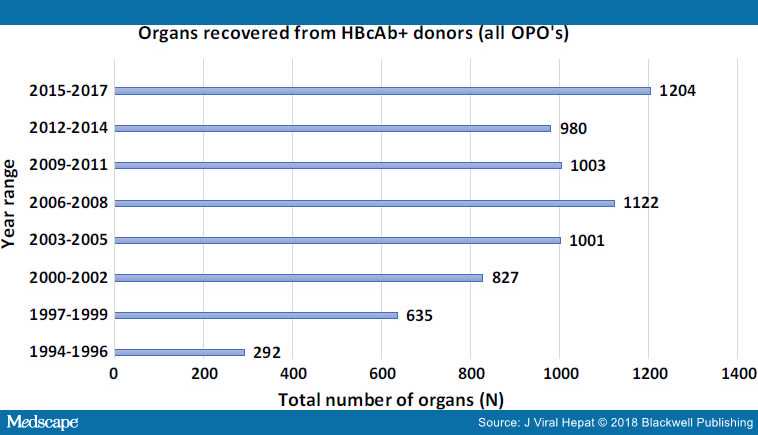
Безопасно ли это?
Dickson и соавторы изучили 1109 пациентов в четырех центрах и показали, что скорость передачи HBV была очень высокой, когда анти-HBc + органы использовались для пересадки HBV-отрицательным реципиентам, если профилактика гепатита В не проводилась после трансплантации (78 % против 0,5%).
Uemto и его коллеги впервые продемонстрировали (период исследования с 1990 по 1996 год), что можно безопасно использовать анти-HBc + органы, если анти-HB иммуноглобулин использовался для профилактики.
Dodson и соавторы изучали комбинацию применения иммуноглобулина anti-HB и Ламивудина для профилактики Гепатита В de-novo, и сообщали в 1999 году, что ни у одного из 8 пациентов, получавших комбинированную профилактику, не было Гепатита В de-novo в течение среднего времени наблюдения (459 дней). Два исследования с 2001 по 2006 год с небольшим количеством пациентов с использованием монотерапии ламивудином показали 0% случаев развития Гепатита В de-novo.
Текущие протоколы лечения и профилактики Гепатита В de-novo варьируются от центра к центру и включают в себя различные продолжительности введения анти-HB иммуноглобулина (HBIG) и использование аналогов нуклезидов, таких как ламивудин, а в последнее время — энтекавир и тенофовир. В центрах, где используется HBIG, нагрузочная доза вводится интраоперационно во время безпеченочной фазы, а затем назначается поддерживающая терапия, чтобы уровень HBIG достигал от 100-200 МЕ / л. Данная терапия проводится от 6 месяцев до пожизненного применения. Недавний метаанализ, который выполнили Wang и соавт. в 2014 году, рассматривающий девятнадцать исследований с 1484 пациентами, показал, что HBIG необходим для уменьшения развития Гепатита В de-novo в посттрансплантационном периоде у пациентов с виремией. В той же работе было показано, что 1-летняя, 3-летняя и 5-летняя выживаемость у пациентов, которые принимали противовирусную терапию перорально составила 97; 87 и 75% соответственно.
Более недавнее исследование, проведенное Shen и соавт., сравнивало комбинацию HBIG с ламивудином или энтекавиром и показало, что последняя комбинация имела улучшенную выживаемость в течение 1, 3 и 5 лет (86,2% против 94,4%, 76,9% против 86,6%, 73,7 % против 82,4%, соответственно, P <0,001).
Результаты трансплантации анти-HВc — положительных органов
В нескольких исследованиях были рассмотрены результаты таких трансплантаций. 30-дневная, 1-летняя и 5-летняя выживаемость пациентов 92% (против 96%), 74% (против 89%) и 74% (против 76%) по сравнению с пациентами, которым проведена трансплантация печени от анти-HBc-отрицательных доноров.
Выживаемость трансплантата в том же исследовании была отмечена как 92% против 94%, 74% против 86% и 65% против 73% (рассмотрены две группы: реципиенты, с органом от донора с анти-HBc + и реципиенты, получившие орган от донора с отрицательным анти-HBc). Также, в исследовании рципиенты с анти-HBc + органами имели более высокий показатель MELD, чем контрольная группа.
На рисунках 2, 3 и 4 показано, что использование этих органов растет. Также показана выживаемость трансплантата и пациента на основе статистики, запрошенной авторами из базы данных UNOS.
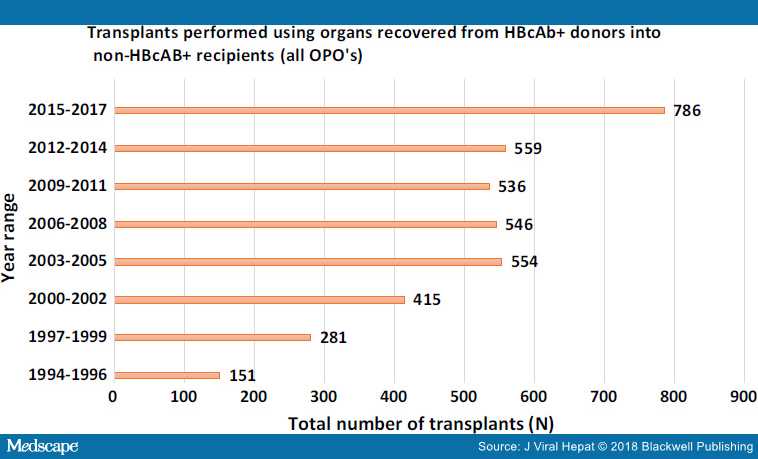
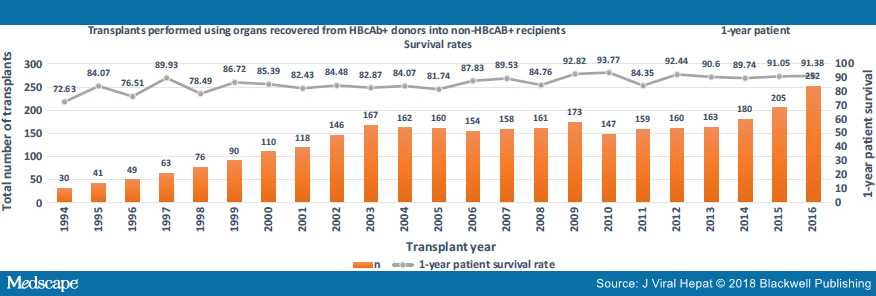
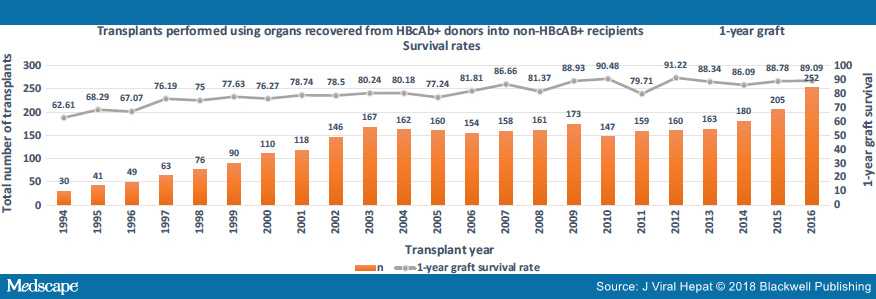
Этично ли использовать такие органы?
Обсудив полезность и безопасность использования анти-HBc + органов, мы можем теперь сосредоточить наше внимание на том, соответствует ли практика использования таких органов стандартам медицинской этики. Четыре основных принципа, которые учитываются при оценке процедуры:
- автономии;
- благодеяния;
- невмешательства (принцип «Не навреди»);
- справедливости.
Принцип автономии.
Принцип автономии определяется как право пациента на полную независимость в принятии медицинских решений.
Пациент должен иметь полную информацию о различных доступных вариантах лечения, о рисках и преимуществах этих вариантов лечения и о результатах лечения. Как отмечено выше, органы против HBc + классифицируются как органы повышенного риска. UNOS изложило свою политику в отношении использования органов, связанных с повышенным риском передачи инфекций, и в этой связи предусмотрено специальное информированное согласие.
Исследователи считают, что необходимо получить специальное согласие у пациента, если он выбрал орган с высоким риском передачи инфекций. Поэтому, по мнению авторов, что в этом отношении соблюдается принцип автономии.
Принцип благодеяния.
Даный принцип относится к концепции делать добро для пациента. Пациенты в списке ожидания декомпенсируются и в силу этого увеличивается их смертность. Предлагая им возможность трансплантации печени, врачи могут устранить причину их заболеваемости, снизить их смертность и значительно улучшить качество жизни. В соответствии с этим стандартом использование анти-HBc + органов для успешной трансплантации выполняет принцип благодеяния.
Принцип невмешательства.
Данный принцип призывает не причинять вреда пациенту. Хотя органы анти-HBc + потенциально могут вызывать гепатит B у реципиентов, имеются много данных, как показано выше, показывающие, что при использовании соответствующих лекарств вирус гепатита B может оставаться бездействующим и вероятность получить активный гепатит В крайне мала.
Центры трансплантации, которые приняли практику использования анти-HBc + органов, включили профилактику HBV как часть протокола лечения после трансплантации. Несмотря на то, что данные протоколы варьируется от центра к центру, адекватное подавление вируса включается в лечение, чтобы гарантировать, что гепатит B не выявится у таких пациентов.
Исходя из вышеперечисленного, использование анти-HBc + органов не ставит реципиентов на неоправданный риск и соответствует определению критерия невмешательства.
Принцип справедливости.
Органы должника справедливо распределяться между реципиентами, исходя из того, как долго они находятся в листе ожидания (очередь). Соответственно, если приходит очередь конкретного пациента, и он согласен получить орган от анти-НВс + донора, то он может получить его. В противном случае, этот реципиент будет ждать орган от потециально не опасного донора.
Исходя из вышеперечисленного, принцип справедливости будет соблюден.
Выводы.
Использование анти-HBc + органов для трансплантации печени не является новым методом. Текущий опыт трансплантации таких органов существует более 25 лет. Существует множество исследований, которые показывают безопасность и эффективность использования таких органов.
В эпоху, когда существует мощная терапия, способная подавлять вирусный гепатит В, можно считать расточительсвом не использования подобного пула доноров. Посттрансплантационная терапия сейчас развилась до такой степени, что эти органы можно безопасно использовать и позволить пациентам с декомпенсированным циррозом вернуться в состояние относительного здоровья и принести пользу обществу в целом. Следующей границей в лечении гепатита B является разработка лекарств и методов лечения, которые обеспечивают функциональное лечение активной репликативной инфекции в значительной степени. Когда эти успехи будут реализованы, использование HBsAg-положительных органов станет возможностью, которая еще увеличит доступность органов и расширит пул доноров.
Авторский коллектив: Nadeem Anwar; Kenneth E. Sherman
Оригинальная статья была опубликована в журнале «Journal of Viral Hepatitis» и доступна по ссылке: https://www.onlinelibrary.wiley.com/doi/full/10.1111/jvh.12962
Перевод: Сёмаш Константин Олесьевич.





Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!