Сосудистые осложнения после трансплантации печени
Сосудистые осложнения, в отличии от билиарных осложнений, не столь часто развиваются после трансплантации печени. Однако, они являются наиболее опасными осложнениями с высоким риском потери трансплантата, поскольку они компрометируют кровоток трансплантата (приток или отток крови).
Данная статья является метаанализом 157 международных научных работ, в котором рассмотрены все типы сосудистых осложнений после трансплантации печени, подходы к их диагностике и лечению.
Сосудистые осложнения после трансплантации печени.
Содержание статьи:
Общая частота сосудистых осложнений в различных мировых центрах разнится, при этом, суммарно она составляет около 7% при трансплантации печени от посмертных доноров, и около 13% при ортотопической трансплантации фрагментов печени от живых доноров.
Поскольку сосудистые осложнения несут максимальную угрозу потери трансплантата, их диагностика и лечение являются серьезным аспектом с точки зрения выживаемости трансплантата и реципиента. Это объясняет, почему в настоящее время многие команды трансплантологов проводят тщательное наблюдение за всеми сосудистыми анастомозами с использованием допплеровской ультрасонографии, которая позволяет оперативно выявлять и лечить данные осложнения до того, как трансплантат печени будет безвозвратно утерян.
Действительно, сосудистые осложнения могут внезапно прервать кровоснабжение печени с высокой степенью потери трансплантата.
Как правило, лечебные мероприятия включают в себя:
- хирургическую реваскуляризацию;
- чрескожный тромболизис;
- чрескожную ангиопластику;
- ретрансплантацию;
- консервативную терапию.
Хотя хирургическое лечение считалось основным выбором для реваскуляризациии трансплантата, успехи в эндоваскулярной хирургии позволили выполнять реваскуляризацию менее инвазивно. В последние десятилетия огромные успехи в области интервенционной радиологии радикально изменили диагностические и терапевтические подходы к ведению пациентов с сосудистыми осложнениями после трансплантации печени.
Фактически, чрескожные эндоваскулярные вмешательства (т. е. тромболитические вмешательства на катетере, баллонная ангиопластика и стентирование), проводимые опытным эндоваскулярным хирургом, стали чаще использоваться и постепенно вытеснять открытую хирургию как терапию выбора при лечении сосудистых осложнений трансплантата печени.
К основным видам сосудистых осложнений после трансплантации печени относятся:
- кровотечение;
- стеноз;
- тромбоз;
- аневризма или псевдоаневризма;
Кровотечение, стеноз и тромбоз могут возникать на любом из сосудистых анастомозов (венозные или артериальные), в то время, как вневризмы/псевдоанверизмы бывают только артериальные.
Артериальные осложнения.
Артериальные осложнения по-прежнему являются основным источником заболеваемости и смертности после ортотопической трансплантации печени. Как правило, трансплантат печени кровоснабжается за счёт воротной вены и за счёт печеночной артерии (печеночных артерий). Печеночная артерия (ПA) играет важную роль, поскольку она обеспечивает кровоснабжение как паренхимы печени, так и желчного древа. Отсутствие или редукция артериального кровотока зачастую приводит к билиарным осложнениям из-за ишемических процессов с образованием некроза желчных протоков, абсцессов печени, что приводит к дисфункции и потере трансплантата. Именно поэтому очень важна быстрая диагностика и лечение сосудистых осложнений.
Основные артериальные осложнения после трансплантации печени:
- тромбоз печеночной артерии (частота развития 1,9%-16,6%);
- стриктура артериального анастомоза (частота развития 0,8-9,3%);
- псевдоаневризма печеночной артерии (частота развития 0,1%-3%);
- разрыв печеночной артерии (артериальное кровотечение, частота развития <1%).
По срокам эти осложнения разделяют на ранние (осложнение случилось в первый месяц после трансплантации печени), а так же на поздние (осложнение развилось позже одного месяца после трансплантации печени).
Особое внимание следует уделять ранним осложнениям, поскольку они связаны с потерей трансплантата и высокой смертностью. В разных исследованиях продолжает обсуждаться сроки ранних и поздних осложнений. Большинство авторов определили поздние осложнения как те, которые произошли после 4 недель от трансплантации, а другие — после 6 месяцев. В данной статье рассматривается последний консенсус, который определяет ранние осложнения, когда они развиваются в течение первого месяца после трансплантации печени.
Тромбоз артерии трансплантата печени.
Тромбоз артерии трансплантата печени (ТАТП) — это наиболее частое (около 50% из всех сосудистых осложнений) и наиболее тяжелое артериальное осложнение. Это одна из основных причин первичной дисфункции трансплантации печени, которая может привести к его потере и смерти пациента в раннем послеоперационном периоде.
В последние годы ранняя реваскуляризация с помощью эндоваскулярного вмешательства использовалась довольно часто для спасения трансплантата, прежде чем рассматривать ретрансплантацию. Действительно, частота ретрансплантаций очень высока при невыполнении реваскуляризации (25% -83%) по сравнению с пациентами, перенесшими реваскуляризацию при трансплантации печени(23-35%).
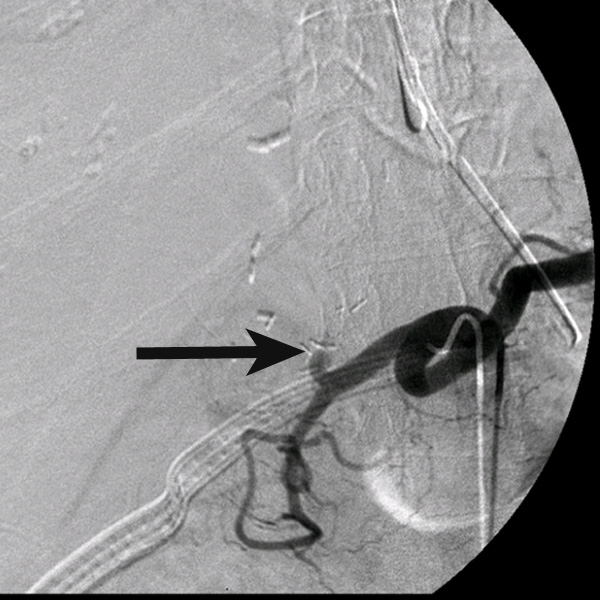
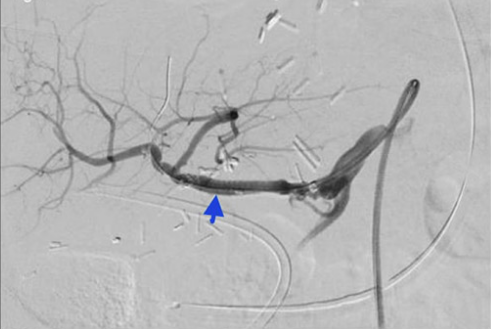
Сосудистые осложнения после трансплантации печени. Ангиография сосудов чревного ствола. Чёрной стрелкой указано место окклюзии печеночной артерии.
Определение.
Тромбоз артерии трансплантата печени (ТАТП)
— окклюзия печеночной артерии тромбом. Согласно классификации сосудистых осложнений, описанной выше, разделяют ранние и поздние тромбозы артерии трансплантата печени.
Заболеваемость.
Истинная частота развития ранних ТАТП неизвестна, но она сильно варьирует (от 0% до 12%). Беккер и соавторы в 2009 году сообщили, что на основе анализа 21822 пациентов, которым была проведена ортотопическая трансплантация печени, зарегистрировано 843 случая (у взрослых и детей) раннего развития ТАТП (3,9%). Также данный анализ показал, что с развитием хирургической техники год за годом количество сосудистых осложнений несколько снизилось. Помимо прочего, в этом отчёте сообщается о том, что в целом по миру, в не зависимости от клиник, количество тромбозов артерий трансплантата печени остаётся примерно одинаковым. Среднее время выявления (развития) тромбоза печеночной артерии составило от 1 до 18 дней с момента трансплантации. Поздние осложнения встречались в среднем через полгода после выполнения трансплантации печени.
В литературе нет однозначных данных, зависит ли частота развития ТАТП от того, была ли трансплантация выполнена от посмертного донора, или же от живого. Многие исследования показывают противоречивые результаты, при этом метаанализ артериальных тромбозов печеночной артерии не обнаружил существенной разницы (3,1 при родственных трансплантациях, 4,6 при трансплантациях печени от посмертного донора). Кроме того, сообщалось, что если при сшивании артериального анастомоза использовался операционный микроскопом лупа, частота тромбозов печеночной артерии оставалась прежней.
Клиническая картина.
Клиническая картина тромбоза печеночной артерии варьируется от незначительного повышения ферментов цитолиза и билирубина в сыворотке периферической крови до фульминантной печеночной недостаточности.
Повышение ферментов цитолиза (АСТ и АЛТ) встречается у 75% пациентов с ТАТП, развитие билиарных осложнений на фоне ТАТП происходит примерно в 15% случаев. Лихорадка и сепсис развивается у 6% пациентов с ТАТП. Острая дисфункция трансплантата или печеночная недостаточность — в 4% случаев.
Выраженность клинических проявлений зависит от времени развития ТАТП, а также от того, насколько развиты сосудистые коллатерали печени.
Билиарные осложнения, например, стриктуры желчных протоков или желчеистечение, иногда приводящие к абсцессам печени, чаще, но не исключительно, связаны с поздним развитием ТАТП, в то время как ранняя дисфункция трансплантата чаще всего бывает связана с ранним развитием ТАТП.
Также, выраженность клинических проявлений зависит от наличия сосудистых коллатералей, которые могут развиваться уже в течение двух недель после трансплантации печени. Поэтому различают две основные формы ТАТП:
- Ранний ТАТП, характеризующийся тяжелым клиническим течением;
- Поздний ТАПТ, характеризующийся более мягким клиническим течением.
Ранний тромбоз артерии трансплантата печени.
В каждом случае, ранний ТАТП клинически проявляется с лихорадкой, лейкоцитозом и повышением уровня ферментов печени. Зачастую развивается ишемия желчных протоков и гепатоцитов с последующей их некротизацией, что приводит к развитию множественных абсцессов печени, за которым следует неконтролируемый септический шок (на фоне иммуносупрессивной терапии) и даже смерть пациента.
Поздний тромбоз артерии трансплантата печени.
Если ТАТП развивается на поздних сроках после трансплантации печени, как правило, клинические проявления связаны с билиарными осложнениями. В 50% случаев поздний ТАТП манифестирует бессимптомно, лишь по данным биохимического анализа крови может определятся незначительное повышение маркёров цитолиза. В последствии, пациенты страдают рецидивирующими холангитами, у некоторых развиваются стриктуры желчных протоков или желчеистечение. Также, развиваются некрозы стенок внутрипеченочных желчных протоков с образованием абсцессов печени.
Как правило, симптоматика позднего ТАТП коварна и требует особого внимания врачей.
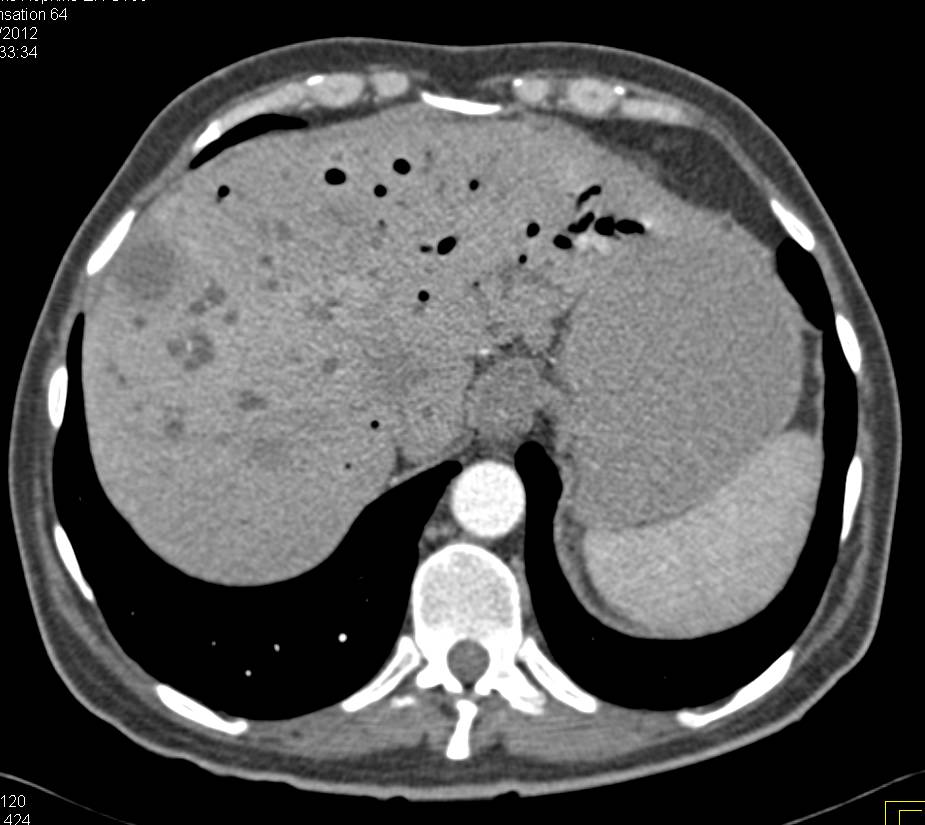
Сосудистые осложнения после трансплантации печени. Компьютерная томограмма. Множественные абсцессы печени на фоне тромбоза артерии трансплантата.
Факторы риска.
Существуют несколько факторов, повышающих риск развития тромбозов артерии трансплантата печени.
К факторам риска раннего ТАТП относят хирургические проблемы, а именно:
- сложности при артериальной реконструкции;
- малый диаметр печеночной артерии;
- большая извитость печеночной артерии;
- рассечение артерии для создание площадки для артериального анастомоза;
- несколько артерий трансплантата;
- артериальные аномалии, требующие сложных артериальных реконструкций, в том числе использования графтов сосудов;
- плохое качество сосудов донора/реципиента.
При этом доказано, что чем выше опыт оперирующей команды, тем ниже риск развития раннего ТАТП, так что, вероятнее всего, хирургические причины, не являются основным фактором риска для развития раннего ТАТП.
К факторам, влияющим на развитие позднего ТАТП, относят:
- Цитомегаловирусную инфекцию;
- Вирусный гепатит С;
- Доноров женского пола;
- Реципиентов мужского пола;
- Табакокурение;
- Ретрансплантацию.
Также, многие авторы считают, что гиперкоагуляционное состояние возможно является основной причиной развития ТАТП.
Диагностика тромбоза артерии трансплантата печени.
Ранняя диагностика ТАТП крайне важна ввиду высокого риска потери трансплантата. К диагностическим процедурам относят биохимический анализ крови (рост ферментов цитолиза) и допплеровскую флуометрию. При необходимости проводят мультиспиральную компьютерную томографию с фнутривенным болюсным контрастированием для оценки кровотока по артериальному руслу трансплантата, или проводится ангиография.
Ультразвуковое исследование с допплеровской флуометрией — ненвазивный метод, и оно является золотым стандартом диагностики. По данным допплеровской флуометрии выявляют снижение уровня артериального кровотока, а также увеличение индекса артериального сопротивления (Resistance Index, Ri).
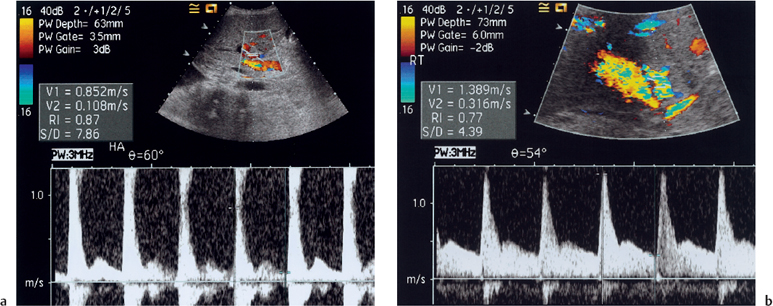
Сосудистые осложнения после трансплантации печени. На изображении слева показана допплеровская флуометрия печеночной артерии с высоким индексом сопротивления (Ri>0.8). Для сравнения — допплерография с нормальными пиками печеночной артерии
Ультразвуковое исследование должно применяться в качестве скринингового метода для ранней диагностики ТАТП. Показано выполнять УЗИ всем пациентам, перенесших трансплантацию печени, не реже 1 раза в сутки. Если у пациента имеется повышение печеночных ферменотов (АЛТ и АСТ), и изменение индексов печеночной артерии, то имеет смысл провести МСКТ с внутривенным болюсным контрастированием и/или ангиографию.
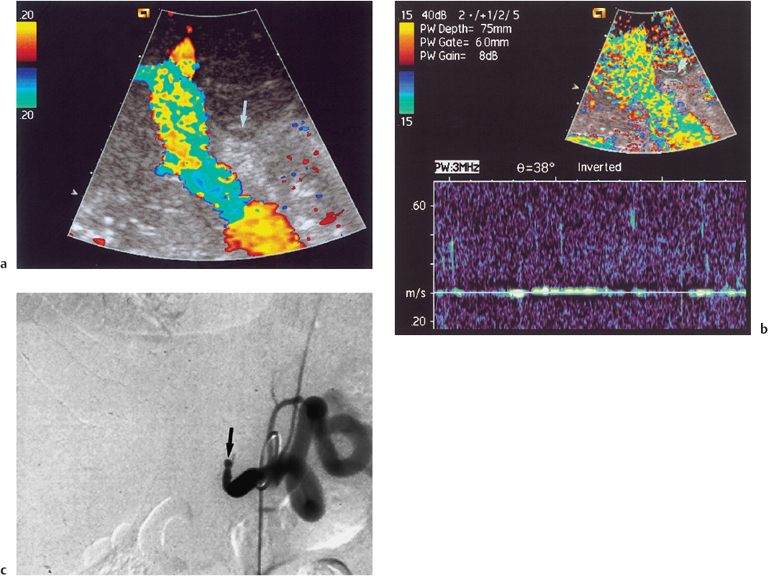
Сосудистые осложнения после трансплантации печени. Отсутствие артериального кровотока по данным УЗИ и доплеровской флуометрии. При ангиографии выявлена окклюзия печеночной артерии трансплантата печени.
Лечение тромбоза артерии трансплантата печени.
Классически, рассматривается несколько вариантов лечения ТАТП:
- реваскуляризация (хирургическая или эндоваскулярная);
- ретрансплантация;
- введение антикоагулянтов/антиагрегантов и динамическое наблюдение.
В настоящее время наиболее эффективный подход к лечению остается спорным, и выбор любого из этих методов лечения зависит от времени постановки диагноза. Ранняя диагностика, оперативная реваскуляризация или ретрансплантация считаются единственным решением для спасения пациентов с ТАТП.
Исторически доказано, что ретрансплантация у пациентов с тромбозом печеночной артерии показывает наилучшие результаты выживаемости пациентов.
С другой стороны, в последнее время сильно развивается чрескожно-чреспеченочные пункционные методики коррекции кровотока, которые показывают неплохие результаты.
Бывают также случаи, когда пациентам не проводится никакого вмешательства, а трансплантат выживает за счёт развивающихся в нём сосудистых коллатералей. Процент таких пациентов крайне мал. При этом, открытая хирургическая реваскуляризация или ретрансплантация также бывают неэффективными.
Несмотря на обнадеживающие результаты эндоваскулярных вмешательств, эффективность и риск осложнений (в основном риском кровотечений во время эндоваскулярной коррекции кровотока) делают такой вариант лечения дискутабельным. Более того, после неудачных попыток эндоваскулярной реваскуляризации кровотока необходимы либо открытые вмешательства, либо ретрансплантация.
Таким образом, срочная реваскуляризация с помощью эндоваскулярных вмешательств в качестве первичного варианта может дать шанс избежать ретрансплантации, однако не во всех случаях она бывает успешной.
Сосудистые осложнения после трансплантации печени. На снимке стрелкой указан стент, установленный в артерию трансплантата печени.
Осложнения эндоваскулярной коррекции тромбоза артерии трансплантата печени:
- повторный тромбоз;
- экстравазация (небольшое повреждение артерии);
- разрыв артерии трансплантата печени с последующим кровотечением.
Любое из этих осложнений требует открытой реваскуляризации или ретрансплантаци печени.
Введение антикоагулянтов/антиагрегантов и динамическое наблюдение.
Некоторым пациентам после коррекции кровотока любым из способов назначают антикоагулянтную/антиагрегантную терапию. Используют ацетилсалициловую кислоту, урокиназу, стрептокиназу, альтеплазу, надропарин кальция, гепарин. Достоверно лучший протокол пока не известен, и в настоящее время нет конкретных рекомендаций по применению тромболитической терапии у таких пациентов. Тем не менее, тромболитическая терапия активно применяется во многих хирургических центрах несмотря на высокий риск послеоперационных кровотечений. Действительно, кровотечения являются наиболее частым побочным эффектом тромболитической терапии и встречаются примерно у 20% пациентов. Кровотечения проявляются в виде от легкого геморрагического отделяемого по страховочным дренажам вплоть до до внутрибрюшного кровоизлияния, которое может быть фатальным в некоторых случаях. Как правило, кровотечения на фоне тромболитической терапии случаются в ранние послеоперационные сроки.
Существует селективный эндоваскулярный тромболизис (препараты вводятся непосредственно в печеночную артерию). Этот метод даёт ряд преимуществ, таких как меньшая тромболитическая доза, высокая локальная концентрация препаратов и небольшое влияние на системную коагуляцию.
Как сообщается по данным из различных источников, довольно хорошим эффектом обладает комбинированная терапия: эндоваскулярная баллонная коррекция коррекция кровотока (со стентированием или без стентирования артерии), совместно с введением антикоагулянтов/антиагрегантов.
Хирургическая реваскуляризация артерии трансплантата печени.
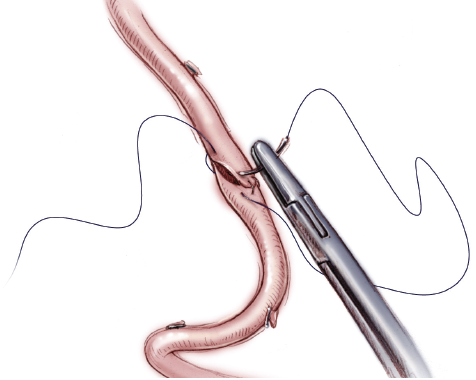
Открытая хирургическая реваскуляризация при тромбозах артерии трансплантата печени трансплантации печени — ещё один вид лечебного пособия для спасения трансплантата. Открытая хирургическая реваскуляризация может выполняться различными способами в зависимости от длины и целостности артерии. Применяют тромбоэктомию катетером Фогарти и проводят реконструкцию анастомоза артерии трансплантата печени.
Метаанализ методов лечения показал, что ретрансплантация печени при ранних тромбозах артерии трансплантата показывает наилучшие результаты выживаемости пациентов, по сравнению с консервативной терапией и реваскуляризацией в различных вариантах.
Напротив, некоторые пациенты с поздним ТАТП выживают без реваскуляризации или ретрансплантации за счёт развития коллатерального кровообращения в трансплантате.
Прогноз.
При реваскуляризации выживаемость пациентов с ТАТП составляет 40%. При комбинированном тромболитическом лечении + реваскуляризация выживаемость составляет 82%. По разным литературным данным, сообщается о об общей смертности 23%-33% пациентов с ранним тромбозом артерии трансплантата печени. Риск потери трансплантата при ТАТП составляет 53,1%.
Выводы.
ТАТП развивается довольно редко, но представляет собой наиболее распространенное сосудистое осложнение после трансплантации печени. Окончательный диагноз устанавливется при помощи ангиографии, во время которой можно провести и лечебные манипуляции с помощью эндоваскулярных процедур, таких как баллонная ангиопластика и/или стентирование артерии.
В настоящее время представляется целесообразным сначала проводить эндоваскулярное лечение, главным образом из-за недостатка донорских органов и высокой смертности, связанной с ретрансплантацией. Однако доказано, что пациенты с ТАТП в раннем послеоперационном периоде с тяжелой дисфункцией трансплантата нуждаются в ретрансплантации печени.
Стриктура артерии трансплантата печени.
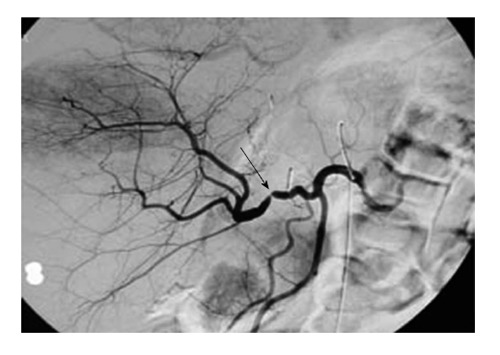
Сосудистые осложнения после трансплантации печени. Ангиография. Стрелкой показано место сужения печеночной артерии трансплантата.
Определение.
Стриктура артерии трансплантата печени (САТП)
— сужение просвета артерии трансплантата печени, приводящее к редукции артериального кровотока и частичной ишемизации трансплантата.
Значительная САТП — это сужение просвета артерии трансплантата более, чем на 50%.
Стриктура артерии трансплантата печени, наряду с тромбозом артерии трансплантата печени, являются наиболее распространенными артериальными осложнениями с высокими показателями заболеваемости и смертности.
Заболеваемость.
По различным литературным источникам, САТП развивается от 2% до 12% после трансплантации печени. Бывают случаи, когда стриктуры печеночной артерии трансплантата, в свою очередь, осложняются тромбозом.
Аналогично с ТАТП, САТП разделяют на ранние (развившиеся в течение первых 30 дней с момента трансплантации печени), и на позднее (развившиеся после 30 дней с момента трансплантации печени).
На основании метаанализа показано, что ранние САТП развиваются статистически реже, нежели поздние (40% против 60% соответственно). Среднее время постановки диагноза САТП составило 94-160 дней после трансплантации печени (1-1220 дней).
Доказано, что анастомотическая часть артерии трансплантата печени является наиболее распространенным местом для развития САТП в течение трех месяцев после трансплантации печени.
Клиническая картина.
Клиническая картина САТП варьирует от бессимптомного течения вплоть до дисфункции трансплантата, связанного с ишемией и некрозом. Более того, САТП может приводить к дисфункции трансплантата как на ранних, так и поздних послеоперационных сроках. Многие пациенты с бессимтомным течением могут демонстрировать незначительные отклонения от нормальных показателей биохимии крови (цитолиз, холестаз). В основном, у пациентов с бессимптомным течением САТП, диагноз устанавливается случайно, во время скрининга УЗДГ (ультразвуковая допплерография). Именно поэтому так важен регулярный сгрининг УЗДГ на ранних и отдалённых сроках после трансплантации печени.
При стенозах артерии трансплантата печени, риск развития билиарных осложнений реже, чем у пациентов с тромбозом артерии трансплантата. В идеале, САТП должна быть диагностирована до возникновения желчных осложнений, поскольку, по данным литературы, после развития САТП билиарные осложнения развиваются в 67% случаев.
Факторы риска.
Факторы риска развития САТП на самом деле не известны и, как представляется, имеют многофакторное происхождение. Многие авторы предлагают технические факторы, такие как повреждения сосудов (при наложении зажимов, расслоение итнимы, неправильное наложение анастомотических швов), анатомические особенности артерий донора и реципиента (чрезмерная длина, перегиб артерии, разница диаметров донорской и реципиентской артерий), нарушение сосудистого кровоснабжения артерии (травма ваза-вазорум) и т.д.
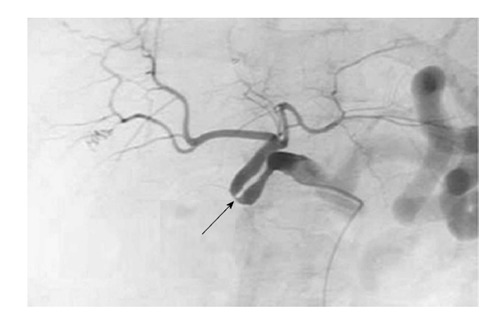
Сосудистые осложнения после трансплантации печени. Стеноз артерии, связанный с перегибом артерии трансплантата.
Диагностика стриктуры артерии трансплантата печени.
УЗДГ — это хорошо зарекомендовавший себя неинвазивный метод оценки проходимости артерии трансплантата печени, а его эффективность в ранней диагностике САТП была отмечена во многих исследованиях.
Оценивается скорость кровотока по артерии в совокупности с индексом сопротивления (Ri) — при стенозах артерии он снижается <0,5, отмечается задержка систолы и «округление» систолического пика.
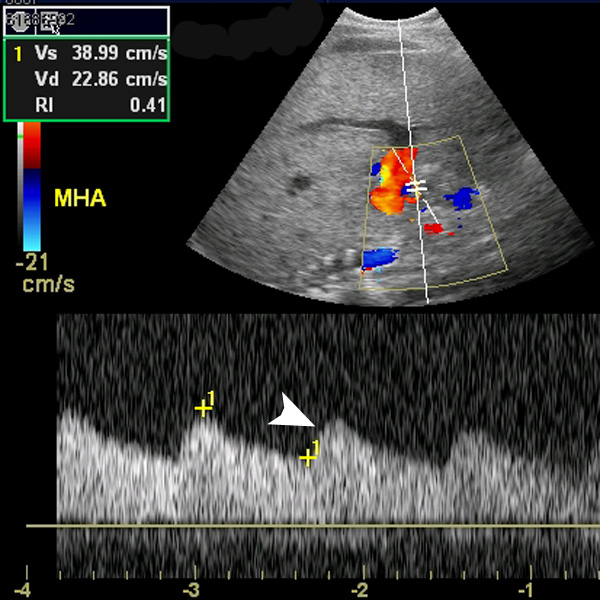
При стенозах артерии трансплантата отмечается снижение индекса сопротивления (Ri) <0,5; отмечается задержка систолы и «округление» систолического пика (показано стрелкой)
Также, к золотым стандартам диагностики САТП относится ангиография.
Лечение стриктуры артерии трансплантата печени.
Как и в случае с тромбозами артерии трансплантата печени, лечение артериальных стриктур включает в себя:
- реваскуляризацию (хирургическую или эндоваскулярную);
- ретрансплантацию.
По данным метаанализа, открытая реваскуляризация с иссечением анастомотического сужения, с применением в некоторых случаях сосудистых графтов, показала стопроцентное восстанволение кровотока по печеночной артерии.
У пациентов с бессимптомным течением САТП выполнялась эндоваскулярная ангиопластика (балонная вазодилатация и/или стентирование артерии трансплантата). Положительный эффект был достигнут у 87% пациентов. У 7% пациентов, которым была выполнена эндоваскулярная ангиопластика, развились осложнения, в том числе разрыв артерии, что потребовало открытой ревизии.
Некоторые авторы отмечают развитие тромбозов артерии транплантата печени после эндоваскулярной коррекции артериальных стенозов. Как правило, это связано с неадекватным послеоперационным ведением пациентов (неправильно подобрана антиагрегантная/антикоагулянтная терапия после стентирования артерии).
Не смотря на это, недавний опубликованный метаанализ серии случаев показал, что интервенционные методы коррекции артериального кровотока являются высоко эффективными при ранних стенозах артерии трансплантата печени, они не отличаются по количеству осложнений, по сравнению с открытыми артериальными реконструкциями, и помогают снизить количество ретрансплантаций печени.
Выводы.
При своевременной ранней диагностике САТП при помощи скрининга УЗДГ и регулярного лабораторного контроля биохимических показателей крови (печеночная панель) и своевременного выполнения реваскуляризации любым из методов, достоверно снижается риск потери трансплантата и ретрансплантации.
Когда эндоваскулярное вмешательство не помогает восстановить кровоток по печеночной артерии, прежде, чем рассматривать ретрансплантацию, которая имеет более низкую послеоперационную выживаемость, следует предпринять хирургическую реваскуляризацию, учитывая то, что САТП ассоциируется с последующими билиарными осложнениями.
Тщательно выполненный артериальный анастомоз при проведении трансплантации, по-видимому, предотвращает развитие артериальных стенозов.
Псевдоанверизма артерии трансплантата печени.
Определение.
Псевдоаневризма артерии трансплантата печени — это образование, возникающее в результате нарушения целостности стенки артерии и продолжающегося кровотечения. Излившаяся кровь скапливается в тканях вокруг артерии образуя опухолевидное образование. Как правило, при трансплантации печени псевдоаневризмы носят ятрогенный характер. Частота их встречаемости по различным данным варьирует от 0,27% до 3%.
Заболеваемость.
Согласно ретроспективному метаанализу, проведенному Volpin и соавт. на 787 трансплантаций печени, проведенных в период с января 1990 по 31 декабря 2005 года, сообщалось о заболеваемости в 2,5%, равномерно распределенной за 16-летний период. Авторы показали, что это осложнение не оказало существенного влияния на какие-либо конкретные лабораторные данные у пациентов после трансплантации печени. У 16 пациентов анатомическая локализация псевдоаневризм была внепеченочной и развилась в ранний период после трансплантации печени. Фактически, большинство псевдоаневризм развилось в раннем послеоперационном периоде в среднем в течение одного месяца после трансплантации: 69% были диагностированы в течение 20 дней и 81% в течение 35 дней после трансплантации печени. Среднее время развития псевдоаневризм составило 13 дней.
Клиническая картина.
Клиническое картина псевдоанвризм варьируется от бессимптомного течения и случайной диагностики при УЗДГ, МСКТ или ангиографии до болей в животе в комплексе с лихорадкой, желудочно-кишечных кровотечений (25% случаев), массивных внутрибрюшных кровотечений в раннем послеоперационном периоде (31 % случаев) и острым геморрагическим шоком (81% случаев).
Факторы риска.
Было предложено несколько предрасполагающих факторов развития псевдоанверизм артерии транплантата печени, включая перитонеальные инфекции, технические трудности при наложении артериального анастомоза, а также желчеистечения.
У пациентов с внепеченочной локализацией псведоаневризм, частота выявления бактерий и грибков при посеве содердимого брюшной полости была очень высока: по различным литературным источникам от 81% до 100% был выявлен бактериальный или фунгальный рост.
Также сообщается, что у некоторых пациентов с желчеистечениями, у которых был наложен билидигестивный анастомоз при трансплантации печени, развивалась псевдоанверизма артерии трансплантата.
Диагностика псевдоаневризмы артерии трансплантата печени.
Дигноз псевдоанверизмы устанавливается на основании проведения инструментальных методов диагностики:
- УЗДГ;
- МСКТ с внутривенным болюсным контрастированием
- МРТ;
- Ангиографии.
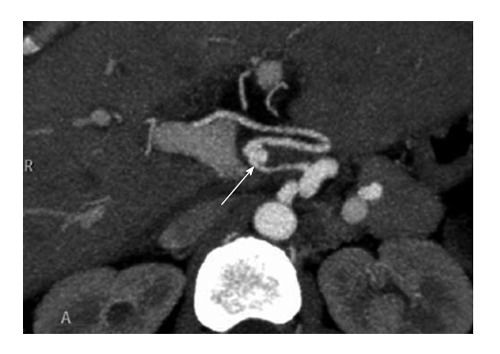
Сосудистые осложнения после трансплантации печени. КТ-ангиография. Стрелкой указана псевдоавнеризма артерии трансплантата печени.
Лечение.
Основными методами лечения псевдоанверизм являются открытая хирургическая операция либо эндоваскулярная коррекция.
Так, по литературным данным, в качестве хирургического некоторым пациентам пособия было выполнено лигирование печеночной артерии. Послеоперационная смертность у таких пациентов достигала 85%, а у тех, пациентов, которые выжили, развивались желчные осложнения, абсцессы печени, которые, в конечном итоге, приводили к необходимости ретрансплантации.
Другой группе пациентов выполнялось иссечение артериального дефекта с последующей артериальной реконструкцией, в том числе с использованием шунитрующих графтов. Послеоперационная смертность в данной группе составила 28%, у 66% пациентов не развилось никаких осложнений после операции. У оставшихся 6% развились билиарные осложнения.
Двоим пациентам было выполнено эндоваскулярное вмешательство. Одному — эмболизация псевданевризмы. Второму — установка покрытого стента. Оба пациента живы более 10 лет и у нех не было никаких осложнений после эндоваскулярного вмешательства.
Прогноз.
В литературе псевдоаневризма артерии трансплантата печени ассоциируется с высокой смертностью от 69% до 100%.
Выводы.
Следует отметить, что раннее распознавание псевдоаневризмы артерии трансплантата печени у пациентов в группе высокого риска (пациент с перитонеальной инфекцией, бактериемией, желчеистечением, с билио-дигистивным анастомозом) имеет решающее значение для проведения диагностической оценки и последующего лечение эндоваскулярными методами коррекции.
Открытое хирургическое вмешательство должно сопровождаться немедленной реваскуляризацией даже в зараженной области, если эндоваскулярное лечение не удалось. Выявление псевдоаневризмы до её разрыва должно обеспечить успешный результат в 100% случаев.
Стоит иметь ввиду, что псевдоаневризма обычно протекает бессимптомно до момента её разрыва, наиболее часто это происходит в первые пять недель после трансплантации печени.
УЗДГ не является высокоэффективным методом диагностики псевдоаневризмы артерии трансплантата печени. Необходимо выполнять МСКТ с болюсным контрастированием, МРТ, либо ангиографию.
Разрыв артерии трансплантата печени.
Определение, заболеваемость и факторы риска.
Разрыв артерии трансплантата печени определяется как тяжелое кровотечение из ствола печеночной артерии. Это довольно тяжелое осложнение, приводящее к нарушению кровоснабжения трансплантата.
Разрыв артерии трансплантата — редкое осложнение (0,64%), как правило в большинстве случаев оно развивается на фоне псевдоанеризмы артерии трансплантата, сопровождающейся инфекцией, либо возникает ятрогенно после эндоваскулярных вмешательств на артерии трансплантата печени.
Разрыв артерии приводит трансплантата печени к высокой смертности пациентов, поэтому он требует экстренного хирургического лечения.
Клиническая картина и диагностика.
Клиническое картина всегда сопровождалась внезапным кровотечением: гемоперитонеум (58,8%), желудочно-кишечные кровотечения (29,4%), гематома (5,9%) и гемобилией у одного пациента(5,7%). Наличие грибковой инфекции в артериальной стенке было подтверждено у 35% пациентов. Желчеистечение наблюдалось у 41% пациентов.
Лечение.
Ввиду того, что разрыв артерии трансплантата печени сопровождается острым кровотечением, доступно множество хирургических вариантов лечения.
При разрывах артерии трансплантата выполняют: эндоваскулярную коррекцию с эмболизацией, стентирование артерии, открытую артериальную реконструкцию, аорто-печеночное шунтирование, лигирование артерии трансплантата, ретрансплантацию.
На сегодняшний день смертность при разрывах артерии трансплантата печени остаётся высокой, поэтому нет определённого консенсуса по выбору конкретной тактики хирургического лечения.
Ранняя послеоперационная смертность у таких пациентов составляет 35%, основными причинами являются повторные кровотечения либо сепсис.
Выводы.
Ретроспективный анализ показал, что реваскуляризация при разрывах артерии трансплантата не всегда показана, поскольку одной из основных причин разрыва является инфекция, и такие пациенты, в последствии, умирают от сепсиса. В исследовании Boleslawski и соавт. (2013 г.) показана эффективность лигирования артерии трансплантата. В их исследовании показано, что 83% пациентов, перенесших реваскуляризацию, умерло в течение 90 дней после реваскуляризации, при этом, все пациенты, перенесшие лигирование, пережили период 90 дней после лигирования артерии трансплантата печени. Однолетняя и трёхлетняя выживаемость пациентов после лигирования артерии трансплантата составила 100% и 80% соответственно, в то время, как у пациентов, перенесших реваскуляризацию, выживаемость составила 14% и 14% соответственно.
Венозные осложнения.
По сравнению с артериальными осложнениями, венозные осложнения встречаются реже с установленной общей частотой около 3%.
Они могут быть потенциально опасными и приводить к дисфункции трансплантата печени и, следовательно, представляют собой важный источник заболеваемости и смертности после трансплантации печени, особенно если они возникают в раннем послеоперационном периоде.
Многочисленные научные исследования показали, что частота венозных осложнений при детских трансплантациях выше, чем у взрослых пациентов.
Венозные осложнения включают в себя осложнения воротной вены и осложнения нижней полой вены.
Осложнения воротный вены.
Частота развития осложнений воротной вены после трансплантации печени низкая (1%-3% пациентов). Данные осложнения более распространены после сплит трансплантации, а также при трансплантации фрагментов печени от живых доноров, и у реципиентов детского возраста.
Тромбоз воротной вены.
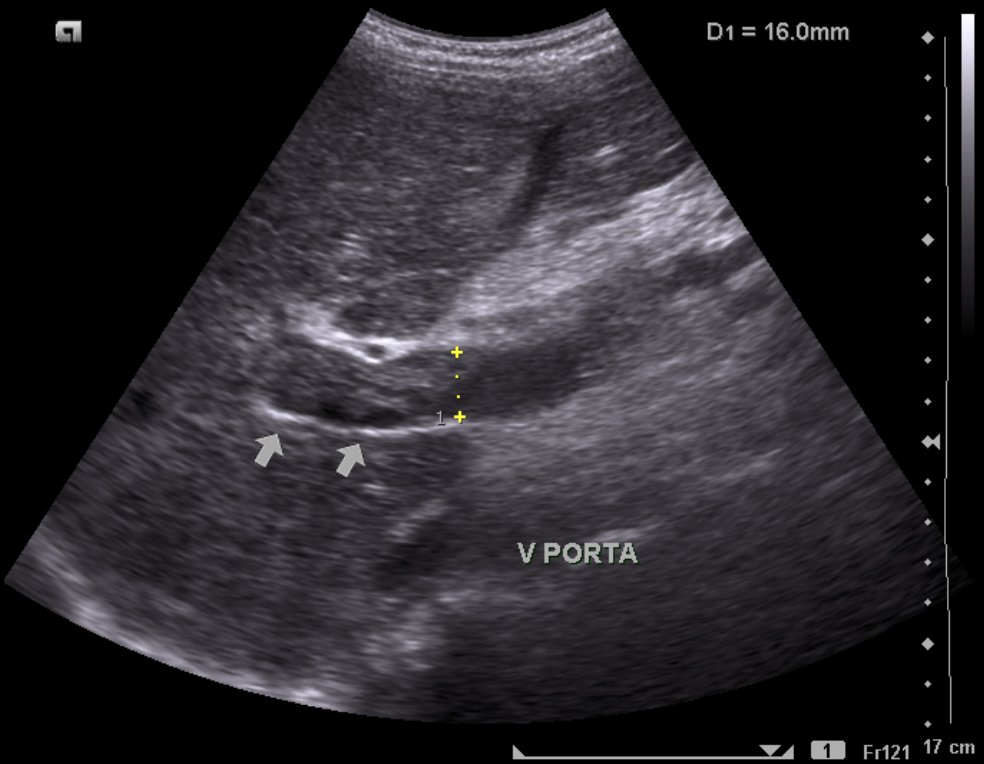
Сосудистые осложнения после трансплантации печени. Ультразвуковая картина тромбоза воротной вены.
Частота тромбозов воротной вены (ТВВ) после трансплантации печени составляет от 0,3% до 2,6%. Однако, частота тромбозов воротной вены у пациентов, получивших трансплантат от живого донора, составляет приблизительно 4%. Это связано с технически более сложной венозной реконструкцией воротной вены во время трансплантации, а так же с тем, что у живого родственного донора не всегда удаётся забрать фрагмент печени с длинным участком воротной вены. ТВВ чаще возникает в ранние послеоперационные сроки, а именно 73% всех ТВВ после трансплантации печени встречаются в первые три месяца после операции.
Клиническая картина.
Клиническая картина зависит от времени возникновения тромбоза. Когда это происходит в ранние послеоперационные сроки, преобладает клиники острой дисфункции трансплантата. Если ТВВ происходит на поздних сроках, клинические симптомы зависят от степени развития коллатерального венозного кровообращения.
Важнейшими клиническими проявлениями являются проявления портальной гипертензии, включая желудочно-кишечные кровотечения из варкозно расширенных вен пищевода.
Факторы риска.
Наиболее распространенными причинами ТВВ являются технические ошибки, связанные с избыточной длинной воротной вены и её перегибами и / или стенозом портального анастомоза.
Другие факторы риска:
- Предшествующие хирургические вмешательства на вортной вене;
- Тромбоз воротной вены до трансплантации печени, требующий тромбэктомии во время операции,
- Малый диаметр воротной вены (<5 мм);
- Спленэктомия в анамнезе;
- Гипоплазия воротной вены;
- Порто-системные шунты;
- использование сосудистых графтов для реконструкции воротной вены.
Дополнительные факторы риска у пациентов, получивших трансплантат от живого донора:
- Малый размер воротный вены (длина и/или диаметр);
- пространственное положение трансплантата печени в брюшной полости.
Диагностика тромбозов воротной вены после трансплантации печени.
Мониторинг УЗДГ должен регулярно выполняться после трансплантации печени для оценки проходимости кровотоков. УЗДГ является самым простым способом оценить проходимость воротной вены трансплантата, скорость кровотока, а также наличие тромбов в портальной системе. Большинство протоколов послеоперационного УЗДГ по миру разниться, при этом считается, что мониторинг УЗДГ сосудов трансплантата должен проводиться ежедневно в течение первых 5-7 дней после трансплантации печени.
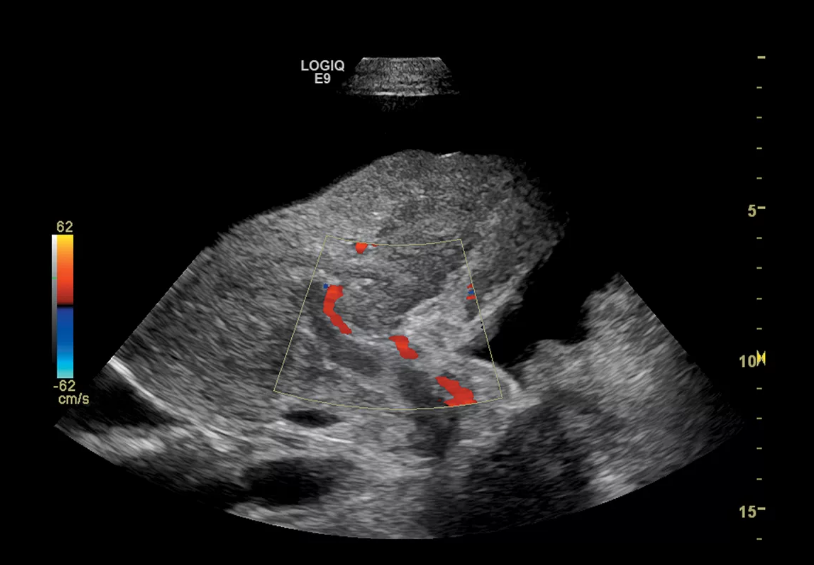
Сосудистые осложнения после трансплантации печени. Ультразвуковая картина тромбоза воротной вены.
Некоторые авторы предложили использовать контрастное ультразвуковое исследование печени МРТ с введением гадолиния — контрастного МР-вещества.
Лечение тромбозов воротной вены после трансплантации печени.
Протоколы лечения включают в себя различные протоколы: от введения антикоагулянтов до открытых операций портальной реконструкции.
В настоящий момент активно применяется чрескожно-чреспеченочная коррекция кровотока воротной вены. К интервенционным методикам относят: баллонную ангиопластику, стентирование воротной вены, введение антикоагулянтов в систему воротной вены через с помощью внутрипеченочного портосистемного шунта (TIPS).
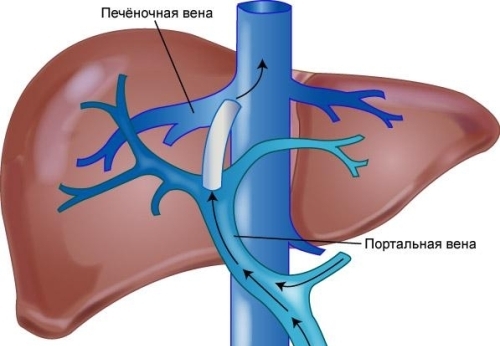
Порто-системный шунт (TIPS)
Помимо всего прочего, подход к лечению ТВВ отличается от того, на каком сроке после трансплантации печени он развился. Так, при раннем развитии ТВВ (в первые 72 часа после трансплантации печени), сопровождающимся острой дисфункцией трансплантата, обязательно выполняется открытая ревищия портального анастомоза, тромбэктомия, реконструкция портального анастомоза.
При ТВВ, развивающихся с 3 по 30 послеоперационных суток, лечение начинают с применения системных антикоагулянтов. Также проводится эндоваскулярная коррекция портального кровотока.
При поздних ТВВ,
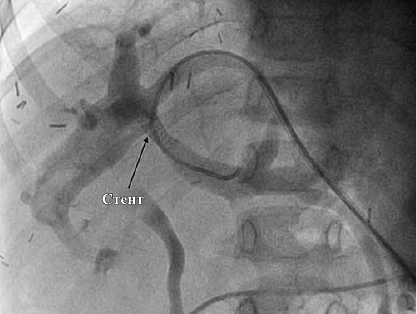
Чрескожная чреспеченочная портография. Стент установлен в месте сужения
В отдалённом периоде после трансплантации печени основными проявлениями тромбоза воротной вены будет синдром портальной гипертенизии (спленомегалия, асцит, расширение вен пищевода, формирование шунтов коллатералей, развитие желудочно-кишечных кровотечений). Как правило, на поздних сроках после трансплантации применяют в первую очередь, эндоваскулярные методики, затем типс TIPS, или открытую хирургическую реконструкцию.
Дополнительно к лечению может потребоваться эндоскопический гемостаз при кровотечениях из варикозно-ррасширенных вен пищевода.
Стоит отменить, что при проведении TIPS или при стентировании воротной вены, пациентам назначаются различные тромболитические протоколы (антиагрегантная/антикоагулянтная терапия).
Прогноз.
Тромбоз воротной вены чреват потерей трансплантата и смертью пациента. Однако при своевременной диагностике и лечении ТВВ, практические данные показывают хороший результат.
Заключение.
ТВВ является редким, но серьезным осложнением, особенно, когда он случается в раннем послеоперационном периоде. Задача хирурга как можно ранее выявить ТВВ при помощи протоколов скрининга УЗДГ. Открытая тромбэктомия требуется при ранних ТВВ, но перкутанные вмешательства постепенно становятся лучшим лечебным вариантом с хорошими результатами и безопасностью.
Стеноз воротной вены.
Истинная частота стенозов воротной вены (СВВ) после трансплантации печени на самом деле неизвестна. По единственным данные, представленным в литературе по поводу данного осложнения, его частота составляет <3%.
Клиническая картина.
Для стенозов воротной вены характера клиника синдрома портальной гипертензии и/или дисфункции трансплантата. На практике большинство пациентов с ССВ жалоб не отмечают, и диагноз стеноза является случайной находкой, обнаруженный при рутинном скрининговом УЗИ.
Если у пациентов развивается клиническая картина, то она, как правило, соответствует клинке портальной гипертензии У таких пациентов могут развиваться желудочно-кишечные кровотечения, асцит и спленомегалия. Лабораторные изменения в биохимической панели не являются постоянными и, следовательно, специфически не значимы для диагностики СВВ.
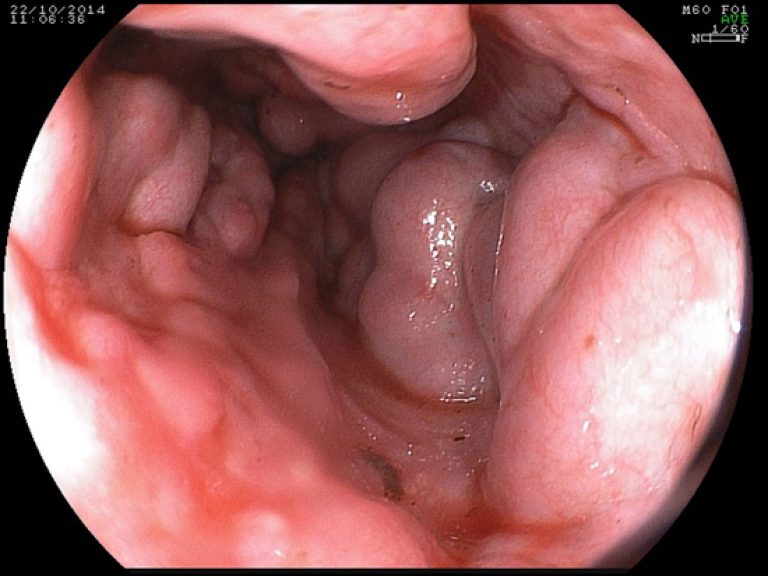
ЭГДС. Варикозно расширенные вены пищевода
Факторы риска.
Аналогично тромбозам воротной вены, основными факторами риска являются хирургические технические ошибки во время трансплантации печени.
Стенозы чаще всего развиваются в технически трудных для выполнения портальных анастомозах. Чаще всего, такие трудности складываются при разнице диаметров воротной вены донора и реципиента. Такое часто бывает при трансплантации фрагментов печени детям.
Диагностика стенозов воротной вены после трансплантации печени.
К основным методом диагностики и скрининга также относится УЗИ (УЗДГ). К критериям постановки диагноза по ультразвуковой картине относятся:
- наличие зоны сужения в воротной вене;
- нормальная или сниженная скорость кровотока по воротной вене до места сужения;
- постстенотическое расширение воротной вены;
- увеличение скорости кровотока (турбулентный кровоток) после места сужения воротной вены.
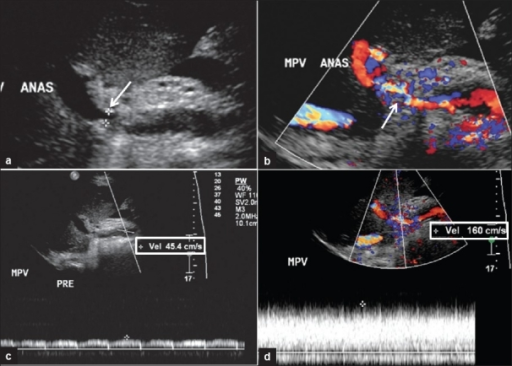
Стеноз воротной вены. a — стрелкой показано место сужения; b — объём кровотока по месту сужения снижен; c — скорость кровотока до сужения снижена; d — турбулентный кровоток в зоне постстенотического расширения.
Однако, по некоторым научным работам, УЗДГ была расценена как чувствительный метод исследования к СВВ, но не специфичный. Ввиду этого были рассчитаны ультразвуковые критерии стеноза воротной вены после трансплантации печени:
- Соотношение диаметров воротной вены до сужения и после сужения >= 50%;
- Скорость кровотока после места сужения больше скорости кровотока до места сужения > 3:1.
Если оба критерия присутствуют, показано выполнение КТ с контрастом для дополнительной диагностики и подтверждения диагноза стеноза воротной вены.
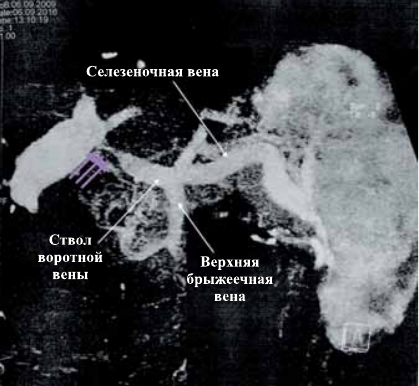
Сосудистые осложнения после трансплантации печени. Стеноз воротной вены. Фиолетовыми стрелками показано место сужения.
Лечение стенозов воротной вены.
Хирургическое лечение, в том числе ревизия анастомоза или ретрансплантация, обычновыполняется при развитии стенозов на ранних сроках после трансплантации печени. В случае бессимптомного течения, пациентом с нормальной функцией трансплантата показано динамическое наблюдение (систематический скрининг УЗДГ) без какого-либо вмешательства.
В случае развития клинических проявлений, методом выбора является чрескожно-чреспеченочные методы коррекции кровотока.Выполняется как баллонная ангиопластика, так и стентирование воротной вены с последующим приёмом антиагрегантов. Минусом стентирования может являться тромбоз стента, что в последующем может привести к необходимости проведения ретрансплантации данному пациенту. Однако на фоне приёма антикоагулянтов/антиагрегантов, доказано, что риск тромбоза стента может быть значительно снижен.
Также, чрескожные вмешательства могут давать риск осложнений, таких как кровотечение в следствие ранения сосудов печени, гемобилия в следствие ранения протоков.
Заключение.
Стеноз воротной вены представляет собой достаточно редкое венозное осложнение после трансплантации печени. Чаще всего он бывает после трансплантации фрагментов печени детям, либол после трансплантации фрагментов печени от живых доноров. УЗДГ является важным диагностическим инструментом, помогающим клиницисту, поскольку большинство бессимптомных случаев могут прогрессировать до тех пор, пока СВВ не будет клинически проявлятся признаками пртальной гипертензии, которая, в свою очередь, что отрицательно скажется на прогнозе выживаемости трансплантата и, в конечном счете, выживания пациента.
Доказанно, что перкутанное вмешательство с размещением стента является предпочтительным методом для лечения с высоким уровнем успеха и низкой частотой рецидивов и/или осложнений.
Осложнение нижней полой вены (кавальные осложнения).
В настоящее время, нарушение оттока крови от трансплантата печени путем перегиба, стеноза или тромбоза нижней полой вены (НПВ) или печеночных вен, особенно при трансплантациях от живых доноров, являются редкими осложнениями после трансплантации печени с зарегистрированной частотой менее 3%.
Клиническая картина и диагностика кавальных осложнений.
Клинические проявления многообразны: отеки нижних конечностей, гепатомегалия, асцит, гидраторакс, синдром Будда-Киари, нарушение функции печени, полиорганная недостаточность, что, в конечном итоге может привести к потере трансплантата и гибели пациента.
Основным фактором риска, приводящим к кавальным осложнениям, являются технические ошибки в выполнении кавального анастомоза, которые приводят к его перегибу или тромбозу в раннем послеоперационном периоде.
В позднем послеоперационном периоде хронический стеноз в области кавального анастомоза является результатом фиброза, гиперплазии и / или внешней компрессии ввиду увеличения трансплантата печени.
Диагноз ставят на основании УЗДГ, КТ с внутривенным контрастированием и с помощью каваграфии, которая позволяет обеспечить лечение во время проведения процедуры.
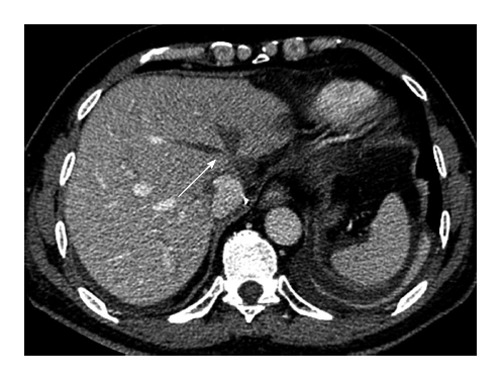
Сосудистые осложнения после трансплантации печени. Мультиспиральная компьютерная томография с внутривенным констрастированием. Стрелкой указано место тромбоза печеночных вен.
Лечение кавальных осложнений.
Методы лечения зависят от того, насколько в отдалённые сроки от трансплантации развились кавальные осложнения. В случае тяжелой дисфункции трансплантата или при развитии мультиорганной недостаточности, всегда показано выполнить ретрансплантацию.
Помимо этого, конкретной ситуации, перкутанные вмешательства являются методом выбора, где смертность после проведения интервенционной операции составляет 11,1% по сравнению с 41,6% для пациентов, которым выполнили ретрансплантацию.
Ангиопластика путем баллонной дилатации может восстановить проходимость анастомоза почти в 100% случаев, но рецидив стеноза случается довольно часто, и могут потребоваться повторная ангиопластика.
В литературе описано, что стентирование кавального анастомоза, может быть лучшим вариантом лечения с высоким уровнем успеха в пределах от 73% до 100% . Этот метод безопасный и показывает хорошие отдалённые результаты.
Заключение и выводы
Сосудистые осложнения по-прежнему остаются серьезной проблемой после трансплантации печени. Они несут высокий уровень смертности, особенно если они манифестируют в раннем послеоперационном периоде (первый месяц) и если их диагностика не была вовремя проведена.
Единственным решением для снижения тяжести течения сосудистых осложнений является их предотвращение этого путем борьбы с факторами риска и, если это невозможно, необходима своевременная диагностика , даже у пациентов с бессимптомным течением.
Многие трансплантологические центры во всем мире выступают за рутинное использование рутинных скриннинговых исследований, таких как УЗИ (УЗДГ), и, если есть сомнения, проводить компьютерную томографию с контрастированием или ангиографию, что является эталоном.
Если выявлено сосудистое осложнение, и у пациента нет тяжелой дисфункции трансплантата печени, целесообразнее попытаться разрешить осложнение путём эндоваскулярной коррекции кровотока, поскольку этот метод продемонстрировал эффективные и безопасные результаты.
И наоборот, если есть серьезные последствия для печени, наиболее эффективной лечебной процедурой является экстренная ретрансплантация, которая показывает лучшие результаты с точки зрения эффективности и выживаемости. Однако но недостаток донорских органов резко ограничивает этот вариант лечения.
Авторский коллектив:Сёмаш К.О., Джанбеков Т.А., Акбаров М.М.
Оригинальная статья была опубликована в журнале «Вестник трансплантологии и искусственных органов» и доступна по ссылке: https://doi.org/10.15825/1995-1191-2023-4-46-72

Огромный объем работы! Спасибо за предоставленную возможность читать эту статью на русском!
Это шикарная статья, спасибо огромное!