Иммуносупрессивная терапия у реципиентов печени
Данная статья — это клинические рекомендации по иммуносупрессивной терапии у реципиентов печени. Рекомендации разработаны международным консенсусным обществом трансплантации печени . Рекомендации будут обновляться с учетом новых доказательств по мере их поступления. Статья предназначена для медицинских работников, которые наблюдают и лечат пациентов до и после трансплантации печени.
Иммуносупрессивная терапия у реципиентов печени.
Содержание статьи:
Введение.
Постоянное улучшение показателей выживаемости пациентов и хорошие результаты трансплантации печени связаны со многими факторами, в том числе и с повышением эффективности иммуносупрессивной терапии. Рациональная фармакотерапия является ключевым фактором для достижения оптимальных результатов после трансплантации. Появление более специфических, мощных иммуносупрессивных препаратов, значительно уменьшало риск потери трансплантата при остром и хроническом отторжении, однако зачастую приводило к увеличению токсичности. Несмотря на то, что у каждого препарата есть рекомендации по применению, схемы лечения различаются в разных трансплантационных центрах.
Международное общество трансплантации печени (ILTS) созвало консенсусную конференцию, в которой принимали участие эксперты-гепатологи, хирурги-трансплантологи, нефрологи и фармакологи для разработки принципов по ключевым аспектам адекватной фармакотерапии иммуносупрессантами. Группа экспертов консенсуса рассмотрела основные принципы иммуносупрессионной фармакотерапии основываясь на обзорах литературы, и затем были сформированы рекомендации по иммуносупрессивной терапии у реципиентов печени.
Данные рекомендации будут обновляться с учетом новых доказательств по мере их поступления. Статья предназначена для медицинских работников, которые наблюдают и лечат пациентов до и после трансплантации печени.
Общие аспекты иммуносупрессии у реципиентов печени.
Иммуносупрессивную терапию у пациентов, перенесших трансплантацию печени, можно разделить на две группы:
- Индукционная иммуносупрессия;
- Поддерживающая иммуносупрессия.
Индукционная терапия.
Индукционная терапия обычно включает в себя назначение внутривенных кортикостероидов сразу после трансплантации печени и продолжается в течение нескольких дней, пока не могут быть начаты пероральные кортикостероиды.
Использование других препаратов для индукционной терапии, таких как антитела к рецепторам IL-2 или антитимоцитарный глобулин увеличивается, поскольку они часто используются, ввиду невозможности применять ингибиторы кальциневрина у пациентов с почечной недостаточностью.
Также индукционную терапию обязательно необходимо применять у пацентов с высокими иммунологическими рисками:
- ретранссплантация при отторжении;
- иммуноопосредованные заболевания печени;
- одновременная трансплантация печени и почки;
- пациенты с частыми аллергическими реакциями в анамнезе.
Поддерживающая иммуносупрессивная терапия.
Основу поддерживающей иммуносупрессивной терапии составляют ингибиторы кальциневрина, причем терапия такролимусом является предпочтительнее циклоспорину для стартовой терапии.
Антипролиферативные препараты, такие как микофеноловая кислота и азатиоприн, а также ингибиторы mTOR могут использоваться для снижения токсичности терапии ингибиторами кальциневрина или для пациентов с более высоким риском отторжения, обычно в сочетании с более высокими дозами ингибиторов кальциневрина.
Раздел 1. Острое и хроническое Т-клеточное и антител-опосредованное отторжение.
Отторжение трансплантата печени остается важной причиной заболеваемости и может привести к потере трансплантата у пациентов, перенесших трансплантацию печени. Значительные успехи в улучшении иммуносупрессивной терапии значительно снизили частоту отторжений и, по большей части, иммуносупрессия, необходимая для лечения отторжения, часто оказывает большее влияние на результаты, чем само отторжение, за исключением позднего острого или хронического отторжения.
Биопсия печени является обязательной при подозрении на отторжение трансплантата. При этом, может потребоваться повторная биопсия трансплантата, если результаты лечения не достигнуты, при этом исключены все другие заболевания.
Т-клеточное отторжение.
Т-клеточное отторжение морфологически характеризуется Т-клеточной инфильтрацией с меньшим количеством популяций других воспалительных клеток. Иммуносупрессия на основе такролимуса более эффективна для снижения частоты и тяжести Т-клеточного отторжения по сравнению с терапией на основе циклоспорина и остается основой для индукционной и поддерживающей иммуносупрессивной терапии.
Тяжесть Т-клеточного отторжения зависит от следующих факторов:
- интенсивность воспаления и его распространения;
- степень повреждения тканей;
- прямые или косвенные признаки сосудистого / ишемического поражения.
Гистологическая классификация должна быть стандартизирована по классификации рабочей группы Banff по патологии трансплантата печени — это глобальная оценка общего уровня отторжения и количественная оценка трех основных гистологических признаков:
- портальное воспаление,
- воспаление / повреждение желчных протоков
- воспаление венозного эндотелия.
На основании этих данных рассчитывается общий индекс активности отторжения (Rejection Activity Index — RAI): не выраженное отторжение (RAI <4), умеренное отторжение (RAI 4-6) и тяжелое отторжение (RAI> 7-9).
Раннее Т-клеточное отторжение.
Раннее Т-клеточное отторжение обычно возникает в течение 90 дней после трансплантации и характеризуется воспалительным повреждением желчных протоков и воспалением в области портальных трактов. Заболеваемость составляет 10-30%, и большинство исследований показывают незначительное влияние на выживаемость трансплантата и пациентов. Лёгкую степень Т-клеточного отторжения следует лечить путем увеличения ингибиторов кальциневрина с добавлением других препаратов (микофенолатов или ингибиторов mTOR) или без них; Пульс-терапия стероидами может не потребоваться. Умеренное и умеренно-тяжелое Т-клеточное отторжение следует лечить с помощью гормональной пульс-терапии. Обычно назначают метилпреднизолон в дозировке 20 мг/кг массы тела в течение трёх дней. При необходимости, также увеличивают дозировку ингибиторов кальциневрина и к терапии добавляют просие иммуносупрессанты.
Пациентам, не реагирующим на терапию, проводят терапию антитимоцитарным глобулином. Можно проводить м ониторинг подмножества T-клеток и B-клеток при использовании тимоглобулина, и его доза может быть увеличена при отсутствии адекватного ответа на лечение. Блокаторы рецепторов IL-2 не играют никакой роли в лечении, и имеются ограниченные данные, подтверждающие использование алемтузумаба.
Важно знать: пациентам, получавших лимфоцитарные антитела или несколько курсов гормональной пульс — терапии необходимо назначать профилактику оппортунистических инфекций (противовирусные, противогрибковые препараты) в течение периода времени, аналогичного после процедуры трансплантации печени — от 3 до 6 месяцев.
Позднее Т-клеточное отторжение.
Позднее Т-клеточное отторжение встречается спустя 90 дней и более у пациентов после трансплантации печени, и наблюдается у 7,5% -23% реципиентов печени. Несколько исследований показали, что позднее Т-клеточное отторжение более часто приводит к потере трансплантата.
Факторы риска позднего Т-клеточного отторжения:
- более молодой возраст реципиентов;
- женский пол;
- аутоиммунная этиология заболевания печени;
- не родственный донор;
- предшествующий эпизод раннего Т-клеточного отторжения;
- несоблюдение рекомендаций врача по иммуносупрессии.
Гистологическая картина может отличаться от классического Т-клеточного отторжения. К примеру, могут наблюдаться очаги воспаления гепатоцитов, инфильтраты плазматических клеток и перивенулит.
Лечение обычно основано на том же алгоритме, который используется для лечения раннего Т-клеточного отторжения (см. выше). Стероид-резистентное отторжение можно наблюдать в небольшом проценте случаев.
Хроническое Т-клеточное отторжение.
Хроническое отторжение обычно развивается от острого отторжения и приводит к потенциально необратимому поражению желчных протоков и / или повреждению сосудов. Частота хронического отторжения составляет примерно 1-5% у взрослых, и до 16% у детей.
Факторы риска хронического Т-клеточного отторжения:
- Аутоиммунная этиология заболевания печени;
- Разногруппная трансплантация;
- иммуносупрессия, где препаратом выбора является циклоспорин;
- несоблюдение рекомендаций врача по иммуносупрессии;
- количество и тяжесть эпизодов Т-клеточного отторжения;
- ретрансплантация по поводу отторжения трансплантата печени.
Минимальные диагностические критерии включают в себя:
- Поражение желчных протоков, затрагивающее более 50% портальных трактов;
- Атрофия / пикноз клеток желчных протоков в большинстве желчных протоков;
- Облитерирующая артериопатия пенистыми клетками.
Рекомендуется в качестве базисного препарата по иммуносупрессии использовать такролимус.
Т-клеточное отторжение: резюме и рекомендации.
Рекомендация 1.1
Диагностика Т-клеточного отторжения (как раннего, так и позднего) должна основываться на результатах гистологических исследований. Повторять биопсию печени после лечения не требуется пациентам с адекватным биохимическим ответом. Однако повторную биопсию печени следует проводить у пациентов с субоптимальным биохимическим ответом, чтобы определиться с дальнейшей тактикой лечения и подбора терапии.
Рекомендация 1.2
Тактику лечения Т-клеточного отторжения следует определять по степени повреждения печени и на основании гистологического результата.
Мероприятия. Лёгкое Т-клеточное отторжение следует лечить путем увеличения дозировки ингибиторов кальциневрина. Пульс-терапия стероидами не показана.
Умеренное и умеренно-тяжелое Т-клеточное отторжение следует лечить путем увеличения дозировки ингибиторов кальциневрина с назначением внутривенной пульс-терапии стероидными гормонами с последующим медленным переходом на пероральный приём кортикостероидов. У некоторых пациентов с тяжелым Т-клеточным отторжением со значительным повреждением трансплантата и холестазом, назначают терапию, элиминирующую антитела.
Стероид-резистентное отторжение следует лечить назначением антитимоцитарного глобулина)
Доказательность рекомендаций: высокая;
Сила рекомендации: сильная.
Рекомендация 1.3. Хроническое T-клеточное отторжение.
Диагноз хронического Т-клеточного отторжения следует подозревать у пациентов с наличем Т-клеточного отторжения в анамнезе, у которых развивается прогрессирующий холестаз, и который не реагирует на коррекцию иммуносупрессивной терапии. Диагноз всегда должен подтверждаться биопсией печени. Лечение хронического Т-клеточного отторжения довольно сложное. Пациенты с хроническим Т-клеточным отторжением, которые получают циклоспорин, должны быть переведены на такролимус.
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Антител-опосредованное отторжение (AMR).
В то время как донор-специфические антитела могут определяться у почти 25% кандидатов на трансплантацию печени, подтвержденное биопсией антител-опосредованное отторжение (AMR) встречается редко (<1% у всех пациентов, и <5% у сенсибилизированных пациентов).
У пациентов с Т-клеточным отторжением, не отвечающих на стандартную терапию, следует исключать AMR.
Для подтверждения диагноза необходимо выполнять биопсию печени.
Лёгкое острое AMR-отторжение реагирует на гормональную пульс-терапию или введение антитимоцитарного глобулина (схема, используемая для лечения умеренно-тяжелого Т-клеточного отторжения).
AMR средней и тяжёлой степени тяжести следует лечить экстракорпоральными методами, такими как плазмаферрез, внутривенным введением иммуноглобулина, ритуксимаба и бортезомиба.
С уществует определенная неясность в отношении диагностики хронического AMR, учитывая то, у пациенотов с хроническим AMR по данным биопсии наблюдались абсолютно нормальные биохимические показатели.
Антител-опосредованное отторжение: резюме и рекомендации.
Рекомендация 1.4
Подтверждение диагноза AMR требует выполнение биопсии печени, по результатам которой будут отмечаться:
- нормальная гистология;
- C4d (+);
- циркулирующие донор-специфические антитела;
- исключение других причин отторжения.
Первоначальное лечение легкого, острого AMR должно начинатсья с гормональной пульс-терапии.
AMR средней и тяжёлой степени тяжести следует лечить экстракорпоральными методами, такими как плазмаферрез, внутривенным введением иммуноглобулина, ритуксимаба и бортезомиба.
Нет достоверных данных по лечению хронического AMR.
Доказательность рекомендаций: хорошая;
Сила рекомендации: умеренная.
Раздел 2. Иммуносупрессивная терапия у пациентов с метаболическим синдромом.
Метаболический синдром — это синдромокомплекс, который характеризуется наличием ожирения, гиперлипидемии, резистентности к инсулину и артериальной гипертонии. Отмечается, что метаболический синдром может развиваться или ухудшаться (при наличии) после трансплантации печени. Сообщается, что риск развития метаболического синдрома de novo после трансплантации печени составляет 33%, 27% и 40% через 3, 6, 12 месяцев соответственно.
Влияние иммуносупрессии на метаболический синдром.
Различные иммуносупрессивные компоненты могут влиять на развитие различных аспектов метаболического синдрома (см. табл. 1). Ингибиторы кальциневрина влияют на развитие гиперлипидемии, гипертонию и сахарный диабет. Кортикостероиды могут влиять на все вышеперечисленные факторы, а также на развитие ожирения. Ингибиторы mTOR влияют на развитие гиперлипидемии.
Таблица 1. Влияние иммуносупрессии на развитие метаболического синдрома.
| Гиперлипидемия | Гипертензия | Ожирение | Сахарный диабет | |
|---|---|---|---|---|
| Ингибиторы кальценеврина | + | ++ | + | ++ |
| Микофенолаты/азатиоприн | — | — | — | — |
| Глюкокортикостероиды | + | + | + | +++ |
| Ингибиторы mTOR | ++ | + | — | — |
| Тимоглобулин | — | — | — | — |
| Антитела к рецепторам IL2 | — | — | — | — |
Посттрансплантационный метаболический синдром и иммуносупрессия.
Рекомендация 2.1
Приём кортикостероидов являются самым большим фактором риска в развитии всех компонентовметаболического синдрома после трансплантации печени, поэтому их приём нужно минимизировать или отменить, если это возможно.
Ингибиторы кальциневрина, в дополнении к независимому развитию почечной недостаточности, способствуют развитию гипертонии и дислипидемии.
Антипролиферативные препараты (азатиоприн и микофенолаты) и антител-редуцирующая терапия (базиликсимаб и тимоглобулин) являются нейтральными в отношении развития метаболического синдрома.
Ингибиторы mTOR влияют на уменьшение веса, снижают риск развития сердечно-сосудистых заболеваний, но, при этом, увеличивают риск дислипидемии.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Лечение ожирения на фоне приёма иммуносупрессии.
Реципиенты печени набирают 10-20% от их изначального веса в первые 6-12 месяцев после трансплантации печени. Если у пациента было ожирение до трансплантации печени, то у пациента имеется высокий риск развития сахарного диабета.
На настоящий момент основные рекомендации по снижению веса при прогрессировании метаболического синдрома после трансплантации печени — это коррекция питания, физические упражнения и, в некоторых случаях, препараты для снижения веса. .
Некоторым пациентам выполняется рукавная гастрэктомия. Её преимущества в том, что пациенты меньше употребляют пищу внутрь ввиду быстрого наступления чувства насыщения, при этом всасывательная способность слизистой желудка не уменьшается, соответственно всасываемость пероральных иммуносупрессантов не нарушится.
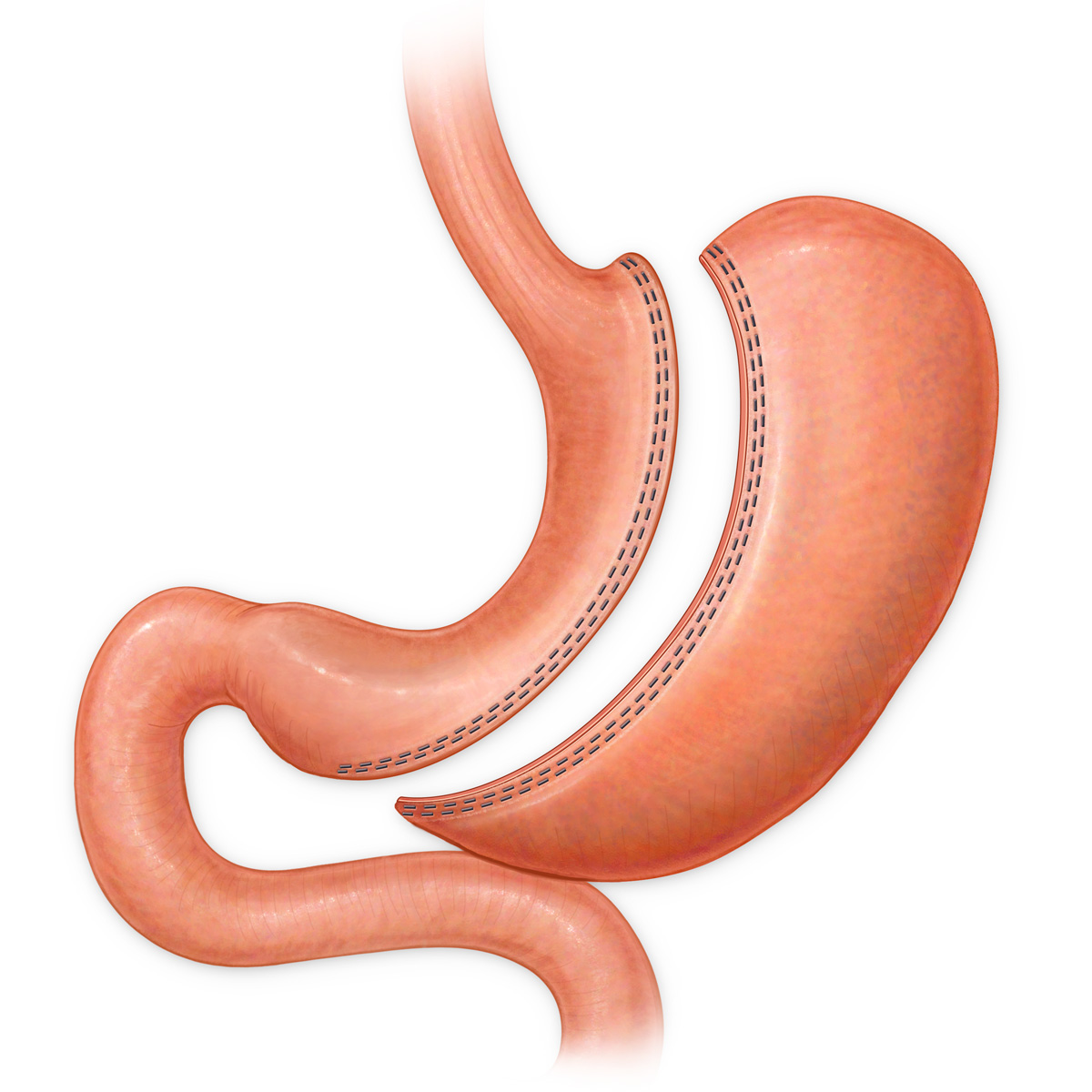
Рукавная гастропластика (гастрэктомия).
Уменьшение дозировки кортикостероидов или отказ от них, имеют хороший эффект в плане снижения веса. Использование ингибиторов mTOR в пользу снижения уровня ингибиторов кальциневрина оказывает также хороший эффект для снижения веса у пациентов с метаболическим синдромом.
Ожирения на фоне приёма иммуносупрессии: резюме и рекомендации.
Рекомендация 2.2
Физическая нагрузка и диета являются краеугольными камнями при повышения жировой массы тела после трансплантации печени.
Конкретные медицинские или хирургические вмешательства при ожирении после трансплантации печени могут рассматриваться индивидуально. Хирургические манипулции могут быть применены у пациентов с тяжелой формой ожирения, устойчивой к поведенческой модификации.Минимизация приёма ингибиторов кальциневрина и кортикостероидов рекомендуется для снижения риска развития ожирения после трансплантации печени.
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Коррекция дислипидемии на фоне приёма иммуносупрессии.
Дислипидемия наблюдается у 40-66% пациентов после трансплантации печени. Иммуносупрессивные препараты (ингибиторы калциневрина, ингибиторы mTOR, глюкокортикостероиды) могут провоцировать развитие дислипидемии. Тем не менее, необходимо проводить динамический контроль липидной панели натощак в течение года.
Важно рассматривать взаимодействие между ингибиторами HMGCoA редуктазы (статины) и ингибиторами кальциневрина, поскольку оба они метаболизируются цитохромом P450-3A4, что приводит к увеличению концентрации статинов, что может увеличить риск рабдомиолиза. Статины следует начинать с более низкой дозы и постепенно титровать. Гидрофильные статины, такие как флувастатин и правастатин, являются предпочтительными, поскольку они не метаболизируются цитохромом P450-3A (см. табл. 2)
Таблица 2. Взаимодействие антигипертензивных препаратов с иммуносупрессантами.
| Статины | Игибиторы АПФ | Антагонисты рецепторов к ангеотензину | Блокаторы кальциевых каналов | |
|---|---|---|---|---|
| Ингибиторы кальциневрина | Повышение концентрации статинов в крови | Повышает риск развития острой почечной недостаточности | Повышает риск развития острой почечной недостаточности | Повышение концентрации ингибиторов кальциневрина в крови |
| Ингибиторы mTOR | Не взаимодействуют | Повышает риск развития
ангионевротического отека
|
Не взаимодействуют | Повышение концентрации ингибиторов mTOR в крови |
| Антипролиферативные препараты | Не взаимодействуют | Не взаимодействуют | Не взаимодействуют | Не взаимодействуют |
Рекомендуется провести оценку риска атеросклеротической сердечно-сосудистой патологии (http://tools.acc.org/ASCVD-Risk-estimator/), а затем необходимо подобрать соответствующую терапии согласно категории риска.
Дислипидемия на фоне приёма иммуносупрессии: резюме и рекомендации.
Рекомендация 2.3
Скрининг: в течение года необходимо проводить скрининговый контроль уровня триглицеридов и липидной панели. Целевой уровень ЛПНП должен быть менее 100 мг/дл. Целевой уровень триглицеридов должен составлять менее 250 мг/дл.
Лечение: все пациенты после трансплантации печени, у которых диагностирована дислипидемия, должны соблюдать диету и поддерживать определённый уровень активности. Если на протяжении 6 месяцев по данным анализов результат не достигнут, то необходимо назначать статины.
Предпочтительнее назначать правастатин, поскольку он не имеет выраженного лекарственного взаимодействия с ингибиторами калциневрина. Остальные статины должны назначаться в половинной дозировке от стандартной. Если пациент получает цилоспорин А, то приём статинов противопоказан.
Если дислипидемия развивается на фоне приёма циклоспорина, таких пациентов рекомендуется перевести на приём такролимуса.
Если дислипидемия развивается на фоне приёма ингибиторов mTOR, назначают препараты, снижающие уровень липопротеидов. Если на этом фоне эффект не достигнут, необходимо снизить дозировку ингибиторов mTOR или назначить другой иммуносупрессивный препарат.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Сахарный диабет на фоне приёма иммуносупрессии.
Сахарный диабет (СД) развивается по разным источникам до 26% случаев после трансплантации печени. Он является основным предиктором неблагоприятных исходов после трансплантации печени, таких как тромбоз печеночной артерии, отторжение трансплантата.
Если у пациента имеется сахарный диабет, который был ДО трансплантации печени, то его течение может ухудшиться после трансплантации.
Факторы, способствующие прогрессированию СД после трансплантации печени:
- иммуносупрессия;
- увеличение веса;
- денервация печени при трансплантации.
Цели коррекции СД аналогичны целям у пациентов без трансплантации, за исключением целевого значения гиликированного гемоглобина (HgbA1c) менее 7,0%. Важным аспектом в лечении СД является коррекция образа жизни пациента: диета и физическая нагрузка.
Такролимус и циклоспорин нарушают синтез и секрецию инсулина бета-клетками. Кортикостероиды могут способствовать резистентности к инсулину посредством увеличения глюконеогенеза, сниженем активности бета-клеток. Ингибиторы mTOR могут снизить пролиферацию бета-клеток и увеличить активацию GLUT-4.
Ранняя гипергликемия после трансплантации часто может быть скоррегирована путем минимизации поддерживающих иммуносупрессантов (кортикостероидов и ингибиторов кальциневрина).
Таблица 3. Аспекты лечения сахарного диабета после трансплантации печени.
| Препарат | Имеющиеся данные по пациентам, перенесших трансплантацию | Особенности |
|---|---|---|
| Метформин | Безопасно назначать при пересадке почки. | Предпочтительно применять с нормальной функцией почек. С осторожностью при острой/хронической почечной недостаточности (лактат-ацидоз). Противопоказан при сепсисе (выраженном инфекционном процессе). Можно применять при нарушении толерантности к глюкозе. |
| Препараты сульфонилмочевины | Эффективность не доказана. | вызывает гипогликемию на фоне острой/хронической почечной недостаточности и приёма ингибиторов кальциневрина. Глипизид или глимепирид предпочтительно назначать при почечной недостаточности. |
| Тиазолидиндионы | Безопасные и эффективные препараты. | Набор веса, развитие хронической сердечной недостаточности, потеря костной ткани. Эффективно при неалкогольном стеатогепатите. |
| Репаглинид | Безопасный и эффективный препарат, не взаимодействует с ингибиторами кальциневрина. | Риск развития гипогликемии со снижением клубочковой фильтрации (СКФ). |
| Ингибиторы ДПП-4 | Вилдаглиптин безопасен, эффективен. | Может понижать СКФ в зависимости от дозировки. |
| Агонисты GLP-1 | Малое количество наблюдений. | Тошнота, влияет на опорожнение желудка, перистальтику кишечника. Не применять при СКФ менее 40 мл/мин. |
| Ингибиторы SGLT-2 | Нет данных | Противопоказан. |
| Ингибиторы альфа-глюкозидазы | Нет данных | Противопоказан при снижении клубочковой фильтрации. |
Сахарный диабет на фоне приёма иммуносупрессии: резюме и рекомендации.
Рекомендация 2.4
Скрининг и мониторинг: Непереносимость глюкозы очень распространена после трансплантации печени. Все реципиенты печени сдавать глюкозу натощак и измерение гликированого гемоглобина, как минимум, 3-6 месяцев после трансплантации, затем через 1 год и ежегодно после этого. Целевой уровень гликированого гемоглобина должен быть <7,0%, скрининг на ретинопатию и протеинурию следует проводить ежегодно.
Лечение: Контроль питания, увеличение физической нагрузки и снижение дозировки кортикостероидов (вплоть до их отмены), являются наиболее важными изменяемыми факторами в ограничении воздействия посттрансплантационного СД. Лекарственная терапия после СД после транслантации печени соответствует стандартам оказания медицинской помощи при СД.
Конверсия с такролимуса на циклоспорин может улучшить контроль над диабетом и непереносимостью глюкозы .
Доказательность рекомендаций: умеренная;
Сила рекомендации: высокая.
Артериальная гипертензия на фоне приёма иммуносупрессии.
Артериальная гипертензия увеличивает риск сердечно-сосудистых заболеваний, хронических заболеваний почек и риск внезапной сердечной смерти. Распространенность гипертонии после трансплантации печени приближается к 70%, при этом пиковые подъёмы артериального давления случаются наиболее часто в раннем послетрансплантационном периоде, что, в первую очередь, связано с влиянием ингибиторов кальцинеприна на функцию почек. Ниже представлены рекомендации ILTS по лечению артериальной гипертензии у пациентов после трансплантации печени.
Таблица 4. Аспекты лечения артериальной гипертензии после трансплантации печени.
| Группа препаратов | Клинические рекомендации |
| Блокаторы кальциевых каналов | Амлодипин и нифедипин являются предпочтительными препаратами ввиду того, что они обладают эффектом, снижающим вазоконстрикцию при одновременном сочетании с ингибиторами кальциневрина. Не-дигидропиридиновые блокаторы кальциевых каналов — дилтиазем и верапамил не рекомендуются к применению из-за их склонности к взаимодействию с ингибиторами кальцневрина и увеличивают их резорбцию. |
| Бетта-блокаторы | Неспецифические бета-блокаторы являются препаратами второй линии, они эффективны также, как и блокаторы кальциевых каналов для лечения артериальной гипертензии у пациентов после трансплантации печени. |
| Ингибиторы АФП или блокаторы рецепторов к ангеотензину-2. | Эти препараты рекомендуются в качестве базисной терапии линии у пациентов после трансплантации печени. |
| Диуретики | Тиазидные и петлевые диуретики могут использоваться для устранения объемной перегрузки, связанной с применением ингибиторов кальциневрина и ингибиторов MTOR у пациентов после трансплантации печени. Следует обратить внимание: на фоне приёма этих препаратов могут быть электролитные нарушения, поэтому обязательно необходимо следить за электролитным составом периферической крови. |
Артериальная гипертензия на фоне приёма иммуносупрессии: резюме и рекомендации.
Рекомендация 2.5
Скрининг и мониторинг: артериальная гипертензия является распространенным нарушением после трансплантации печени. Все реципиенты печени должны проводить измерение уровня артериального давления как минимум, ежедневно в течение первого года после операции. Целевое артериальное давление: <130/80 мм рт.ст.
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Лечение: сочетание коррекции образа жизни и минимизации иммуносупрессии, особенно кортикостероидов и ингибиторов кальциневрина, являются важными изменяемыми факторами в механизме развития артериальной гипертензии. Меры в отношении коррекции образа жизни должны включать ограничение приёма в пищу соли, снижение массы тела, и проведение регулярных физических нагрузкок.
Доказательность рекомендаций: умеренная;
Сила рекомендации: высокая.
Раздел 3. Минимизация иммуносупрессии.
Все пациенты после трансплантации печени длительно получают иммуносупрессивную терапию. Поэтому подбор иммуносупрессивной терапии должен быть направлен на выявление соответствующего типа (ов) лекарственного средства и его дозировки, которая подавляет аллоиммунные реакции, одновременно минимизируя неблагоприятные последствия иммуносупрессии. Идентификация идеального режима иммуносупрессии для каждого отдельного пациента начинается во время трансплантации и основывается главным образом на клиническом представлении во время трансплантации и этиологии печеночной недостаточности.
Персонализацию иммуносупрессии можно рассматривать как корректировку протоколов иммуносупрессии, которые учитывают характеристики реципиентов, этиологию первичного заболевания печени и степень аллоиммунных реакций.
Стратегии минимизации иммуносупрессии наиболее безопасны при инициации в течение первых трёх послеоперационных месяцев и должны, в общем, рассматриваться в контексте биохимических показателей (печёночная панель), которые должны оставаться стабильными после очередной коррекции иммуносупрессивного протокола по меньшей мере в течение 4 недель.
Нет необходимости в выполнении биопсии печени перед началом минимизации иммуносупрессивной терапии. Если во время корректировки протоколов ухудшаются показатели биохимии печени, первым шагом является возврат к предыдущей дозе / или режиму иммуносупрессии. Если после возврата к предыдущему протоколу анализы не восстановились, рекомендуется выполнение биопсии печени для исключения реакции позднего отторжения. В целом, минимизация иммуносупрессии с клинической точки зрения возможна и безопасна.
Минимизация иммуносупрессии: резюме и рекомендации.
Рекомендация 3.1
Всем пациентам, перенесших трансплантацию печени, можно применять протоколы снижения иммуносупрессии.
Исключения:
- пациенты, у которых по данным биопсии, выявлено стероид-резистентное отторжение;
- пациенты, которым трансплантация печени выполнена по причине аутоиммунных заболеваний печени;
- пациенты, у у которых подтверждено антител-опосредованное отторжение (AMR).
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Отмена гормональных препаратов.
Спустя 3 месяца после трансплантации печени большинству пациентов можно снижать гормональную иммуносупрессию вплоть до полной отмены. Рекомендация заключается в медленном снижении дозы кортикостероидов с целью прекращения лечения. Как указано выше, у пациентов с более высоким иммунологическим риском (например, иммуно-опосредованными заболеваниями) следует учитывать либо поддержание низких доз стероидов в течение длительного времени, либо добавление микофенолатов (либо других групп иммуносупрессоров) для безопасной отмены стероидов.
Монотерапия ингибиторами кальциневрина.
Пациенты, которые в течение первых трёх месяцев после трансплантации печени оставались стабильными, и их анализы не вызывали претензий, являются кандидатами на монотерапию ингибиторами кальциневрина. Взрослым реципиентам, как правило, назначается такролимус пролонгированного действия. В противном случае, назначается такролимус обычного действия, в некоторых странах существуют протоколы приёма такролимуса обычного действия 1 раз в стуки (суточная доза) с целью улучшения комплаэнтности к лечению со стороны пациента.
Целевая концентрация такролимуса должна составлять 6-10 нг/мл.
Если препаратом выбора является циклоспорин, то рекомендуемый уровень концентрации должен составлять от 150 до 200 нг/мл.
С 3 по 12 месяц после трансплантации доза ингибиторов кальциневрина может медленно снижаться при регулярном контроле биохимических показателей. К концу первого года уровень такролимуса должны быть около 5 нг/мл, а уровень циклоспорина — около 100 нг/мл.
Начиная с 1-го года, концентрацию такролимуса можно снизить до 3 нг/мл. После 5-го года уровень лекарственного средства менее важен, если наблюдается хорошая функция трансплантата, о чем свидетельствуют стабильные и нормальные биохимические показатели. Однако полное прекращение иммуносупрессии должно быть ограничено клиническими испытаниями.
Переход с двухкомпонентного протокола иммуносупрессии на монотерапию.
Пациенты, получающие двухкомпонентный протокол иммуносупрессии, могут рассматриваться к переводу на монотерапию в любой момент времени после трансплантации печени (обычно> 1 год). Обязательное условия — низкий иммунологический риск.
В качестве монотерапии могут быть назначены:
- такролимус, с рекомендуемой концентрацией препарата около 5 нг/мл;
- эверолимус сс рекомендуемой концентрацией препарата от 3 до 8 нг/мл;
- микофенолаты в расчётной дозе (900*площадь поверхности тела), но не более 1440 мг в сутки для микофеноловой кислоты и не более 2000 мг в сутки для микофенолата миофетила).
ILTS также сообщает, что некоторые центры используют сиролимус у пациентов после трансплантации печени. Тем не менее, консенсусная группа не давала никаких рекомендаций по использованию сиролимуса, учитывая, что она не одобрена FDA и имеются другие альтернативы (everolimus).
Стратегии минимизации иммуносупрессии: резюме и рекомендации.
Рекомендация 3.2
Кортикостероиды: через 3 месяца после трансплантации печени большинству пациентов можно планово отменять кортикостероиды; пациентам с более высоким иммунологическим риском (например, имунно-опосредованные заболевания печени, стероид-резистентное отторжение) необходима поддерживающая терапия кортикостероидами или их замена на антипролиферативные препараты.
Ингибиторы кальциневрина: все пациенты, которые имеют показания к минимизации иммуносупрессии, являются потенциальными кандидатами на монотерапию ингибиторами кальциневрина уже через 3 месяца после трансплантации печени.
Переход на монотерапию: Пациентам, которые не переносят монотерапию ингибиторами кальциневрина или при более высоком иммунологическом риске, следует назначать двойной протокол иммуносупрессии, предпочтительно из следующих групп препаратов: ингибиторы калциневрина, микофенолаты или эверолимус .
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Раздел 4. Малигнизация и иммуносупрессия.
Малигнизация является одним из наиболее важных и опасных осложнений у реципиентов печени. Наиболее распространенными видами рака являются:
- немеланомный рак кожи;
- рецидивирующая гепатоцеллюлярная карцинома (ГЦК);
- не-ходжкинская лимфома;
- рак легких;
- рак почек.
Пациенты, которым пересадка выполнена по поводу алкогольного цирроза или первичного склерозирующего холангита, особенно подвержены риску малигнизации.
Модуляция иммуносупрессивных протоколов может изменить развитие специфических злокачественных опухолей, и наиболее широко признанными иммунодепрессантами в этой категории являются ингибиторы mTOR, которые имеют противоопухолевые эффекты. Фактически, ингибиторы mTOR одобрены для лечения некоторых злокачественных новообразований, включая нейроэндокринные опухоли, рак почек, астроцитому, рак поджелудочной железы и некоторые раковые опухоли молочной железы.
Иммуносупрессия и гепатоцеллюлярная карцинома.
Имеются некоторые данные, свидетельствующие о том, что высокий уровень иммуносупрессии может быть связан с более высокими показателями рецидива ГЦК. Более длительные курсы кортикостероидов и более высокие уровни ингибиторов кальциневрина связаны с повышенным риском рецидива.
Результаты ретроспективных исследований свидетельствуют о том, что ингибиторы mTOR, прежде всего сиролимус, уменьшают рецидив ГЦК примерно на 50%, и несколько метаанализов подтверждают эти данные.
Основываясь на этих многообещающих результатах, было проведено рандомизированное контролируемое исследование (РКИ) для изучения влияния сиролимуса на рецидив ГЦК. 525 реципиентов печени с ГЦК были отобраны для этого исследования. Несмотря на отсутствие различий в отсутствии рецидивов или общей выживаемости при приёме сиролимуса в конце исследования (8-й год), пациенты пациенты, которым трансплантация была выполнена в соответствии с миланскими критериями, и которым назначали сиролимус, имели меньший риск рецидива ГЦК и большую 5-летнюю выживаемость. Будут ли показаны схожие данные для препарата эверолимус, который одобрен для трансплантации печени, в отличие от сиролимуса, неизвестно.
Иммуносупрессия и рак кожи.
В ранних наблюдениях сообщалось о значительно меньшей заболеваемостью раком кожи кожи у реципиентов почки, которым назначался сиролимус. Эти результаты были подтверждены в метаанализе для реципиентов печени.
Иммуносупрессия и другие злокачественные новообразования.
Поскольку лечение злокачественных новообразований после трансплантации очень проблематично, кандидаты на трансплантацию пеечени проходят активный скрининг на злокачественные опухоли. Пациенты со злокачественными новообразованиями, как правило, не допускаются к трансплантации.
Малигнизация и иммуносупрессия: резюме и рекомендации.
Рекомендация 4.1
Гепатоцеллюлярная карцинома: помимо снижения общей иммуносупрессии, оптимальная стратегия иммуносупрессии для минимизации частоты и тяжести рецидива ГЦК, включая использование ингибиторов mTOR, не определена.
Рак кожи: имеются доказательства того, что сиролимус снижает риск рецидива рака кожи у пациентов с пересадкой почки. Оказывается ли тот же эффект при эверолимусе, который одобрен при трансплантации печени, неизвестен, но кажется вероятным.
Прочие злокачественные опухоли: нет прямых доказательств того, что ингибиторы mTOR предотвращают другие злокачественные новообразования у реципиентов печени, хотя есть вероятность положительного исхода у пациентов с нейроэндокринными опухолями или раком почки при приёме эверолимуса.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Раздел 5. Иммуносупрессия при трансплантации печени детям.
Иммуносупрессия в педиатрической практике несколько сложнее, нежели у взрослых реципиентов печени. Это связано с тем, что дети растут, часто болеют. Так же имеются определенные особенностей в фармакокинетике препаратов у детей. Все эти особенности усложняют ведение педиатрических реципиентов печени.
Индукционная иммуносупрессия в педиатрической практике.
Обзор центров, зарегистрированных в исследованиях по пересадке печени детям, показал, что более 90% используют такролимус, в качестве первичного иммуносупрессанта. Такролимус, как правило, предпочтительнее циклоспорина, поскольку последний обладает повышенной нефротоксичностью, может вызывать гирсутизм и гиперплазию дёсен. Также циклоспорин может иметь меньшую биодоступность, что связано с наличием билио-дигестивного анастомоза, обычно используемого у детей при выполнении трансплантации.
Большинство центров, которые занимаются педиатрической трансплантацией печени, используют индукцию такролимусом на 0-1 послеоперационные сутки в сочетании с внутривенным введением кортикостероидов.
Треть международных центров используют индукционную терапию либо антагонистами рецепторов IL-2, либо анти-тимоцитарным глобулином. При индукционной терапии введение такролимуса может быть отложено до 3-5 послеоперационных суток.
Поддерживающая иммуносупрессия в педиатрической практике.
Ингибиторы кальциневрина обеспечивают высокоэффективную иммуносупрессию после трансплантации печени. Оптимальная концентрация таколимуса составляют 8-12 нг/мл в течение 0-3 месяцев после трансплантации, 6-10 нг/мл через 3-6 месяцев и приблизительно 5-7 нг/мл через 6 месяцев после трансплантации.
Кортикостероиды следует отменять в течение первых 12 месяцев, если это необходимо. Цель большинства центров — достичь монотерапии такролимусом в течение одного года после трансплантации печени. Большинство опрошенных центров установило строгий мониторинг, если иммуносупрессия еще более агрессивно сведена к минимуму.
Лекарственный контроль после трансплантации печени детям.
Множественные факторы влияют на концентрацию препаратов у детей. Этими факторами являются возраст, путь введения препарата, лекарственная форма препарата, функция трансплантата, взаимодействие с лекарственными средствами и подвижность кишечника (перистальтика).
На стационарном лечении, контроль концентрации препаратов необходимо проводить со следующими интервалами:
- Ингибиторы кальциневрина — каждые 2-4 приёма (каждые 2-3 дня);
- Ингибиторы mTOR — каждые 5-8 дней;
- Эверолимус- каждые 2-3 дня;
- Микофенолаты — не нуждаются в контроле.
Подбор иммуносупрессии основываясь на исходном диагнозе (причине цирроза).
Более агрессивные схемы индукции после трансплантации могут быть оправданы для пациентов с более высоким иммунологическим риском, например: ABO несовместимые трансплантации, ретрансплантация по поводу острого отторжения или положительный cross-match тест.
Напротив, центры часто избегают агрессивной индукции для пациентов, которые в настоящее время или ранее имели злокачественные опухоли или у пациентов с острой печеночной недостаточностью.
В некоторых центрах для пациентов с аутоиммунным заболеванием печени используются антипролиферативные перпараты, такие как микофенолаты или азатиоприн в сочетании с ингибиторами кальциневрина. Применение ингибиторов mTOR в качестве предполагаемых противоопухолевых агентов описано для пациентов с посттрансплантационными лимфопролиферативными расстройствами и другими злокачественными новообразованиями, такими как гепатобластома.
Комплаэнтность пациентов и их родственников.
Строгое соблюдения режима дозирования иммуносупрессии всегда является центральной проблемой в педиатрической трансплантации, поскольку, зачастую, родители или опекуны пациента могут быть не комплаэнтны. Преднамеренное или непреднамеренное несоблюдение режима приёма лекарств может приводить к дисфункции трансплантата или к другим осложнениям.
Комплаэнтность может быть оценена по показаниям пациента / семьи, пополнению и подсчету количества таблеток, концентрации иммуносупрессии и биохимическим показателям крови.
Депрессия, посттравматическое стрессовое расстройство, жестокое обращение с детьми, импульсивность и невнимательность, плохая внутрисемейная атмосфера и отсутствие социальной поддержки могут способствовать несоблюдению режима приёма препаратов. В таких случаях необходимо, чтобы на помощь приходили специалисты в области психического здоровья и социальной помощи.
Также, к факторам несоблюдения режима приёма препаратов относятся:
- лекарственная форма препарата;
- вкусовые качества препарата;
- стоимость препарата;
- частота и сроки приема лекарств;
- мужской пол;
- небелая раса / этническая принадлежность;
- подростковый период.
Приверженность к приёму препаратов должна постоянно решаться с помощью открытого общения с пациентом. Инструкции по приёму препаратов должны быть последовательными, простыми и практичными. Было показано, постоянные и регулярные беседы с пациентом, система позитивного подкрепления, а так же напоминания (будильник) может способствовать упрощению режима дозирования препаратов для пациентов.
Иммуносупрессия при трансплантации печени детям: резюме и рекомендации.
Рекомендация 5.1
Такролимус является препаратом выбора для первичной и поддерживающей иммуносупрессии после трансплантации печени.
Если индукционная терапия проводилась используется сразу же после трансплантации печени, инициация терапии ингибиторами кальциневрина может быть отложена, как правило, на срок до 4-5 дней. Индукционная терапия сопровождаемая немедленным введением ингибиторов кальциневрина и антипролиферативными препаратами показана пациентам с высоким иммунологическим риском.
Ингибиторы mTOR могут играть важную роль у пациентов с предшествующим или активным онкологическим процессом.
Рекомендуется в течение первого года после трансплантации переходить на монотерапию такролимусом (по показаниям).
Приверженность к приёму препаратов должна решаться с помощью открытого общения с пациентом или с его опекунами, а использование технологий для напоминания о приёме препаратов необходимо вводить повсеместно.
Доказательность рекомендаций: умеренная;
Сила рекомендации: высокая.
Раздел 6. Иммуносупрессия у пациентов с почечной недостаточностью.
Оценка функции почек у кандидатов на трансплантацию печени.
Диагностика и постановка острой почечной недостаточности (ОПН) у пациентов с заболеваниями печени должна основываться на клиренсе креатинина сыворотки крови.
Хроническая болезнь почек (ХБП) определяется как отклонения в структуре почек (протеинурия, аномальный осадок мочи, гистология почек и/или почечная недостаточность) или снижение скорости клубочковой фильтрации (СКФ) в течение 3 месяцев. ХБП следует классифицировать по степени тяжести в соответствии с данными в таблице №5.
Таблица 5. Классификация хронической болезни почек.
| ХБП (Степень) | Скорость клубочковой фильтрации (mL/min/1.73 m^2) |
| 1 |
≥90 |
| 2 |
60-89 |
| 3a |
45-59 |
| 3b |
30-44 |
| 4 |
15-29 |
| 5 |
<15 |
Хотя значения креатинина используются для начальной оценки функции почек, их следует интерпретировать с осторожностью у пациентов, перенесших трансплантацию печени,потому что необходимо будет переоценить скорость клубочковой фильтрации, особенно у пациентов с недоеданием и перегрузкой по жидкости.
Оценка функции почек: резюме и рекомендации.
Рекомендация 6.1
Перед трансплантацией необходимо использовать уравнение MDRD-6 для определения оценочной скорости клубочковой фильтрации.
После третьего послеоперационного месяца следует использовать уравнение MDRD-4, 6 или CKD-EPI для определения оценочной скорости клубочковой фильтрации.
Данные уравнения следует использовать осторожно для оценки функции почек у этой популяции пациентов, поскольку они склонны переоценивать СКФ. Возможно потребуется использовать дополнительные формулы для измерения СКФ и высчитывать среднее значение.
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Влияние почечной недостаточности на исход трансплантации печени.
Дисфункция почек встречается у 50% амбулаторных пациентов с декомпенсированным циррозом и 20-25% госпитализированных пациентов с циррозом печени. Частота смертности, инфекций и осложнений, связанных с циррозом, возрастает с тяжестью почечной недостаточности.
Во время трансплантации 20-25% пациентов имели СКФ <30 мл/мин/1,73 м2. Заболеваемость ОПН после трансплантации печени колеблется от 17 до 94% по разным источникам. Чем выше тяжесть почечной недостаточноси и потребности в заместительной почечной терапии, тем выше возрастает смертность после трансплантации печени. Причины ОПН связаны с нарушениями гемодинамики, первичной дисфункции трансплантата, использование нефротоксических препаратов и ушивание полой вены.
После трансплантации печени кумулятивная частота ХПН 3 стадии и выше колеблется от 36-57%. Пациенты с ХПН 4 стадии и выше имеют повышенный риск смерти. Общая частота возникновения ХПН после трансплантации печени через 5 лет у пациентов с MELD <20 и у пациентов с MELD> 20 при составила 17% и 37% соответственно.
Наиболее частой причиной развития дисфункции почек является приём ингибиторов кальциневрина. Другими дополнительными факторами являются мембранопролиферативный гломерулонефрит, сахарный диабет, нефропатия IgA, острый тубулярный некроз.
Индукционная иммуносупрессия у пациентов с почечной недостаточностью.
Ранний послеоперационный период
Схемы на основе ингибиторов кальциневрина являются причиной почечной дисффункции от 13% до 33% случаев в зависимости от того, вводятся ли ингибиторы кальциневрина отдельно или в сочетании с антиметаболитами или индукционной терапией. В двух крупнейших рандомизированных контролируемых исследованиях (исследования Respect and Diamond) индукционная терапия проводилась препаратом анти-IL-2R в комбинации с микофенолатами и с начальной низкой дозой пролонгированного такролимуса или отсроченным введением такролимуса. Данные исследования показали значительное улучшение функции почек.
В отсутствие комбинированной терапии с микофенолатами, уровень концентрации в течение первого месяца после трансплантации, варьируется от 8 до 15 нг/мл.
В более поздних исследованиях с использованием индукционной терапии и / или в комбинации с микофенолатами уровень концентрации такролимуса в течение первого месяца варьировался от 6 до 8 нг/мл с аналогичной частотой отторжений.
Мета-анализ двух РКИ показал, что при почечной недостаточности (n = 712), уменьшение концентрации таколимуса (<10 нг / мл) в течение первого месяца после трансплантации снижает риск возникновения почечной недостаточности по сравнению с обычной концентрацией такролимуса (> 10 нг / мл).
Ранние исследования показали, что использование сиролимуса в раннем послеоперационном периоде было связано с высокой частотой печеночных артериальных тромбозов, потерей трансплантата и смертью, ввиду этого, препарат крайне не рекомендована для индукционной иммуносупрессии.
Индукционная иммуносупрессия и почечная недостаточность: резюме и рекомендации.
Рекомендация 6.2
Индукционная терапия препаратом анти-IL-2R в комбинации с микофенолатами и с начальной низкой дозой пролонгированного такролимуса или отсроченным введением такролимуса показывает наилучший эффект по предотвращению почечной недостаточности после трансплантации печени.
Доказательность рекомендаций: умеренная;
Сила рекомендации: высокая.
Средний и долгосрочный послеоперационные периоды.
На данный момент нет чёткого определения среднего и долгосрочного послеоперационного периода после трансплантации печени. Однако, принимая во внимание изменения приёма и дозирования иммуносупрессивных препаратов, среднесрочный период можно рассматривать в течение 1-6 месяцев после трансплантации и долгосрочный ≥ 1 года после трансплантации печени.
Рекомендация 6.3
Раннее назначение эверолимуса в течение первого в сочетании с низкими дозами такролимуса ( концентрация ≤ 5 нг / мл) приводит к значительно лучшей почечной функции, чем при стандартном дозировании такролимуса. Эта стратегия особенно полезна у пациентов с хроническим заболеванием почек (ХБП>= 3, СКФ 60 мл/мн/1,7 м^2).
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Рекомендация 6.4
Снижение дозировки ингибиторов кальциневрина должна быть предпринята у пациентов с ХБП в конце раннего послеоперационного периода. Позднее (> 1 год) назначение ингибиторов mTOR оказывает нечеткое влияние на функцию почек, особенно у пациентов с ХБП ≥ 3.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Симультанная трансплантация печени и почки.
У пациентов с одновременной трансплантацией печени и почки острое клеточное отторжение и антител-опосредованное отторжение случаются довольно редко. Тем не менее, трансплантаты печени могут не полностью защищать почечный аллотрансплантат, особенно с наличием предшествующих антител.
В серии из 140 реципиентов печень+почка с долгосрочным наблюдением пограничное клеточное, острое клеточное, антител-опосредованное и хроническое отторжение почек наблюдались у 11,4%, 6,4%, 1,4% и 0,7% пациентов соответственно. Острое клеточное и хроническое отторжение печени были диагностированы у 11,4% и 2,9% пациентов соответственно.
Taner et al. также сообщали, что у таких реципиентов по сравнению с реципиентов трансплантата почки моно ассоциируется с более редким возникновением хронического клеточного и антител-опосредованного отторжения.
Рекомендация 6.5
Индукционная терапия при симультанной трансплантации печени и почки, например, антитимоцитарным глобулином, может быть рассмотрена у пациентов с высокой иммунологической активностью (положительный кросс-матч, высокие уровни предшествующих антител). Индукционная терапия также может быть рекомендована пациентам с отстроченной функцией почечного трансплантата с целью задержки и / или минимизации использования ингибиторов кальциневрина.
Ингибиторы кальциневрина, в идеале — такролимус, в сочетании с кортикостероидами и микофенолатами, рекомендуются в качестве поддерживающей поддержания иммуносупрессии у реципиентов печени и почки.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Резюме.
В данной статье была рассмотрена иммуносупрессивная терапия у реципиентов печени. Данные клинические рекомендации были сформированы на основании метанаализов 173 источников. Дата выхода рекомендаций — 2018 г. По мере поступления новых рекомендаций данная статья будет дополняться.Данная статья — это клинические рекомендации по иммуносупрессивной терапии у реципиентов печени. Рекомендации разработаны международным консенсусным обществом трансплантации печени . Рекомендации будут обновляться с учетом новых доказательств по мере их поступления. Статья предназначена для медицинских работников, которые наблюдают и лечат пациентов до и после трансплантации печени.
Иммуносупрессивная терапия у реципиентов печени.
Введение.
Постоянное улучшение показателей выживаемости пациентов и хорошие результаты трансплантации печени связаны со многими факторами, в том числе и с повышением эффективности иммуносупрессивной терапии. Рациональная фармакотерапия является ключевым фактором для достижения оптимальных результатов после трансплантации. Появление более специфических, мощных иммуносупрессивных препаратов, значительно уменьшало риск потери трансплантата при остром и хроническом отторжении, однако зачастую приводило к увеличению токсичности. Несмотря на то, что у каждого препарата есть рекомендации по применению, схемы лечения различаются в разных трансплантационных центрах.
Международное общество трансплантации печени (ILTS) созвало консенсусную конференцию, в которой принимали участие эксперты-гепатологи, хирурги-трансплантологи, нефрологи и фармакологи для разработки принципов по ключевым аспектам адекватной фармакотерапии иммуносупрессантами. Группа экспертов консенсуса рассмотрела основные принципы иммуносупрессионной фармакотерапии основываясь на обзорах литературы, и затем были сформированы рекомендации по иммуносупрессивной терапии у реципиентов печени.
Данные рекомендации будут обновляться с учетом новых доказательств по мере их поступления. Статья предназначена для медицинских работников, которые наблюдают и лечат пациентов до и после трансплантации печени.
Общие аспекты иммуносупрессии у реципиентов печени.
Иммуносупрессивную терапию у пациентов, перенесших трансплантацию печени, можно разделить на две группы:
- Индукционная иммуносупрессия;
- Поддерживающая иммуносупрессия.
Индукционная терапия.
Индукционная терапия обычно включает в себя назначение внутривенных кортикостероидов сразу после трансплантации печени и продолжается в течение нескольких дней, пока не могут быть начаты пероральные кортикостероиды.
Использование других препаратов для индукционной терапии, таких как антитела к рецепторам IL-2 или антитимоцитарный глобулин увеличивается, поскольку они часто используются, ввиду невозможности применять ингибиторы кальциневрина у пациентов с почечной недостаточностью.
Также индукционную терапию обязательно необходимо применять у пацентов с высокими иммунологическими рисками:
- ретранссплантация при отторжении;
- иммуноопосредованные заболевания печени;
- одновременная трансплантация печени и почки;
- пациенты с частыми аллергическими реакциями в анамнезе.
Поддерживающая иммуносупрессивная терапия.
Основу поддерживающей иммуносупрессивной терапии составляют ингибиторы кальциневрина, причем терапия такролимусом является предпочтительнее циклоспорину для стартовой терапии.
Антипролиферативные препараты, такие как микофеноловая кислота и азатиоприн, а также ингибиторы mTOR могут использоваться для снижения токсичности терапии ингибиторами кальциневрина или для пациентов с более высоким риском отторжения, обычно в сочетании с более высокими дозами ингибиторов кальциневрина.
Раздел 1. Острое и хроническое Т-клеточное и антител-опосредованное отторжение.
Отторжение трансплантата печени остается важной причиной заболеваемости и может привести к потере трансплантата у пациентов, перенесших трансплантацию печени. Значительные успехи в улучшении иммуносупрессивной терапии значительно снизили частоту отторжений и, по большей части, иммуносупрессия, необходимая для лечения отторжения, часто оказывает большее влияние на результаты, чем само отторжение, за исключением позднего острого или хронического отторжения.
Биопсия печени является обязательной при подозрении на отторжение трансплантата. При этом, может потребоваться повторная биопсия трансплантата, если результаты лечения не достигнуты, при этом исключены все другие заболевания.
Т-клеточное отторжение.
Т-клеточное отторжение морфологически характеризуется Т-клеточной инфильтрацией с меньшим количеством популяций других воспалительных клеток. Иммуносупрессия на основе такролимуса более эффективна для снижения частоты и тяжести Т-клеточного отторжения по сравнению с терапией на основе циклоспорина и остается основой для индукционной и поддерживающей иммуносупрессивной терапии.
Тяжесть Т-клеточного отторжения зависит от следующих факторов:
- интенсивность воспаления и его распространения;
- степень повреждения тканей;
- прямые или косвенные признаки сосудистого / ишемического поражения.
Гистологическая классификация должна быть стандартизирована по классификации рабочей группы Banff по патологии трансплантата печени — это глобальная оценка общего уровня отторжения и количественная оценка трех основных гистологических признаков:
- портальное воспаление,
- воспаление / повреждение желчных протоков
- воспаление венозного эндотелия.
На основании этих данных рассчитывается общий индекс активности отторжения (Rejection Activity Index — RAI): не выраженное отторжение (RAI <4), умеренное отторжение (RAI 4-6) и тяжелое отторжение (RAI> 7-9).
Раннее Т-клеточное отторжение.
Раннее Т-клеточное отторжение обычно возникает в течение 90 дней после трансплантации и характеризуется воспалительным повреждением желчных протоков и воспалением в области портальных трактов. Заболеваемость составляет 10-30%, и большинство исследований показывают незначительное влияние на выживаемость трансплантата и пациентов. Лёгкую степень Т-клеточного отторжения следует лечить путем увеличения ингибиторов кальциневрина с добавлением других препаратов (микофенолатов или ингибиторов mTOR) или без них; Пульс-терапия стероидами может не потребоваться. Умеренное и умеренно-тяжелое Т-клеточное отторжение следует лечить с помощью гормональной пульс-терапии. Обычно назначают метилпреднизолон в дозировке 20 мг/кг массы тела в течение трёх дней. При необходимости, также увеличивают дозировку ингибиторов кальциневрина и к терапии добавляют просие иммуносупрессанты.
Пациентам, не реагирующим на терапию, проводят терапию антитимоцитарным глобулином. Можно проводить м ониторинг подмножества T-клеток и B-клеток при использовании тимоглобулина, и его доза может быть увеличена при отсутствии адекватного ответа на лечение. Блокаторы рецепторов IL-2 не играют никакой роли в лечении, и имеются ограниченные данные, подтверждающие использование алемтузумаба.
Важно знать: пациентам, получавших лимфоцитарные антитела или несколько курсов гормональной пульс — терапии необходимо назначать профилактику оппортунистических инфекций (противовирусные, противогрибковые препараты) в течение периода времени, аналогичного после процедуры трансплантации печени — от 3 до 6 месяцев.
Позднее Т-клеточное отторжение.
Позднее Т-клеточное отторжение встречается спустя 90 дней и более у пациентов после трансплантации печени, и наблюдается у 7,5% -23% реципиентов печени. Несколько исследований показали, что позднее Т-клеточное отторжение более часто приводит к потере трансплантата.
Факторы риска позднего Т-клеточного отторжения:
- более молодой возраст реципиентов;
- женский пол;
- аутоиммунная этиология заболевания печени;
- не родственный донор;
- предшествующий эпизод раннего Т-клеточного отторжения;
- несоблюдение рекомендаций врача по иммуносупрессии.
Гистологическая картина может отличаться от классического Т-клеточного отторжения. К примеру, могут наблюдаться очаги воспаления гепатоцитов, инфильтраты плазматических клеток и перивенулит.
Лечение обычно основано на том же алгоритме, который используется для лечения раннего Т-клеточного отторжения (см. выше). Стероид-резистентное отторжение можно наблюдать в небольшом проценте случаев.
Хроническое Т-клеточное отторжение.
Хроническое отторжение обычно развивается от острого отторжения и приводит к потенциально необратимому поражению желчных протоков и / или повреждению сосудов. Частота хронического отторжения составляет примерно 1-5% у взрослых, и до 16% у детей.
Факторы риска хронического Т-клеточного отторжения:
- Аутоиммунная этиология заболевания печени;
- Разногруппная трансплантация;
- иммуносупрессия, где препаратом выбора является циклоспорин;
- несоблюдение рекомендаций врача по иммуносупрессии;
- количество и тяжесть эпизодов Т-клеточного отторжения;
- ретрансплантация по поводу отторжения трансплантата печени.
Минимальные диагностические критерии включают в себя:
- Поражение желчных протоков, затрагивающее более 50% портальных трактов;
- Атрофия / пикноз клеток желчных протоков в большинстве желчных протоков;
- Облитерирующая артериопатия пенистыми клетками.
Рекомендуется в качестве базисного препарата по иммуносупрессии использовать такролимус.
Т-клеточное отторжение: резюме и рекомендации.
Рекомендация 1.1
Диагностика Т-клеточного отторжения (как раннего, так и позднего) должна основываться на результатах гистологических исследований. Повторять биопсию печени после лечения не требуется пациентам с адекватным биохимическим ответом. Однако повторную биопсию печени следует проводить у пациентов с субоптимальным биохимическим ответом, чтобы определиться с дальнейшей тактикой лечения и подбора терапии.
Рекомендация 1.2
Тактику лечения Т-клеточного отторжения следует определять по степени повреждения печени и на основании гистологического результата.
Мероприятия. Лёгкое Т-клеточное отторжение следует лечить путем увеличения дозировки ингибиторов кальциневрина. Пульс-терапия стероидами не показана.
Умеренное и умеренно-тяжелое Т-клеточное отторжение следует лечить путем увеличения дозировки ингибиторов кальциневрина с назначением внутривенной пульс-терапии стероидными гормонами с последующим медленным переходом на пероральный приём кортикостероидов. У некоторых пациентов с тяжелым Т-клеточным отторжением со значительным повреждением трансплантата и холестазом, назначают терапию, элиминирующую антитела.
Стероид-резистентное отторжение следует лечить назначением антитимоцитарного глобулина)
Доказательность рекомендаций: высокая;
Сила рекомендации: сильная.
Рекомендация 1.3. Хроническое T-клеточное отторжение.
Диагноз хронического Т-клеточного отторжения следует подозревать у пациентов с наличем Т-клеточного отторжения в анамнезе, у которых развивается прогрессирующий холестаз, и который не реагирует на коррекцию иммуносупрессивной терапии. Диагноз всегда должен подтверждаться биопсией печени. Лечение хронического Т-клеточного отторжения довольно сложное. Пациенты с хроническим Т-клеточным отторжением, которые получают циклоспорин, должны быть переведены на такролимус.
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Антител-опосредованное отторжение (AMR).
В то время как донор-специфические антитела могут определяться у почти 25% кандидатов на трансплантацию печени, подтвержденное биопсией антител-опосредованное отторжение (AMR) встречается редко (<1% у всех пациентов, и <5% у сенсибилизированных пациентов).
У пациентов с Т-клеточным отторжением, не отвечающих на стандартную терапию, следует исключать AMR.
Для подтверждения диагноза необходимо выполнять биопсию печени.
Лёгкое острое AMR-отторжение реагирует на гормональную пульс-терапию или введение антитимоцитарного глобулина (схема, используемая для лечения умеренно-тяжелого Т-клеточного отторжения).
AMR средней и тяжёлой степени тяжести следует лечить экстракорпоральными методами, такими как плазмаферрез, внутривенным введением иммуноглобулина, ритуксимаба и бортезомиба.
С уществует определенная неясность в отношении диагностики хронического AMR, учитывая то, у пациенотов с хроническим AMR по данным биопсии наблюдались абсолютно нормальные биохимические показатели.
Антител-опосредованное отторжение: резюме и рекомендации.
Рекомендация 1.4
Подтверждение диагноза AMR требует выполнение биопсии печени, по результатам которой будут отмечаться:
- нормальная гистология;
- C4d (+);
- циркулирующие донор-специфические антитела;
- исключение других причин отторжения.
Первоначальное лечение легкого, острого AMR должно начинатсья с гормональной пульс-терапии.
AMR средней и тяжёлой степени тяжести следует лечить экстракорпоральными методами, такими как плазмаферрез, внутривенным введением иммуноглобулина, ритуксимаба и бортезомиба.
Нет достоверных данных по лечению хронического AMR.
Доказательность рекомендаций: хорошая;
Сила рекомендации: умеренная.
Раздел 2. Иммуносупрессивная терапия у пациентов с метаболическим синдромом.
Метаболический синдром — это синдромокомплекс, который характеризуется наличием ожирения, гиперлипидемии, резистентности к инсулину и артериальной гипертонии. Отмечается, что метаболический синдром может развиваться или ухудшаться (при наличии) после трансплантации печени. Сообщается, что риск развития метаболического синдрома de novo после трансплантации печени составляет 33%, 27% и 40% через 3, 6, 12 месяцев соответственно.
Влияние иммуносупрессии на метаболический синдром.
Различные иммуносупрессивные компоненты могут влиять на развитие различных аспектов метаболического синдрома (см. табл. 1). Ингибиторы кальциневрина влияют на развитие гиперлипидемии, гипертонию и сахарный диабет. Кортикостероиды могут влиять на все вышеперечисленные факторы, а также на развитие ожирения. Ингибиторы mTOR влияют на развитие гиперлипидемии.
Таблица 1. Влияние иммуносупрессии на развитие метаболического синдрома.
| Гиперлипидемия | Гипертензия | Ожирение | Сахарный диабет | |
|---|---|---|---|---|
| Ингибиторы кальценеврина | + | ++ | + | ++ |
| Микофенолаты/азатиоприн | — | — | — | — |
| Глюкокортикостероиды | + | + | + | +++ |
| Ингибиторы mTOR | ++ | + | — | — |
| Тимоглобулин | — | — | — | — |
| Антитела к рецепторам IL2 | — | — | — | — |
Посттрансплантационный метаболический синдром и иммуносупрессия.
Рекомендация 2.1
Приём кортикостероидов являются самым большим фактором риска в развитии всех компонентовметаболического синдрома после трансплантации печени, поэтому их приём нужно минимизировать или отменить, если это возможно.
Ингибиторы кальциневрина, в дополнении к независимому развитию почечной недостаточности, способствуют развитию гипертонии и дислипидемии.
Антипролиферативные препараты (азатиоприн и микофенолаты) и антител-редуцирующая терапия (базиликсимаб и тимоглобулин) являются нейтральными в отношении развития метаболического синдрома.
Ингибиторы mTOR влияют на уменьшение веса, снижают риск развития сердечно-сосудистых заболеваний, но, при этом, увеличивают риск дислипидемии.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Лечение ожирения на фоне приёма иммуносупрессии.
Реципиенты печени набирают 10-20% от их изначального веса в первые 6-12 месяцев после трансплантации печени. Если у пациента было ожирение до трансплантации печени, то у пациента имеется высокий риск развития сахарного диабета.
На настоящий момент основные рекомендации по снижению веса при прогрессировании метаболического синдрома после трансплантации печени — это коррекция питания, физические упражнения и, в некоторых случаях, препараты для снижения веса. .
Некоторым пациентам выполняется рукавная гастрэктомия. Её преимущества в том, что пациенты меньше употребляют пищу внутрь ввиду быстрого наступления чувства насыщения, при этом всасывательная способность слизистой желудка не уменьшается, соответственно всасываемость пероральных иммуносупрессантов не нарушится.

Рукавная гастропластика (гастрэктомия).
Уменьшение дозировки кортикостероидов или отказ от них, имеют хороший эффект в плане снижения веса. Использование ингибиторов mTOR в пользу снижения уровня ингибиторов кальциневрина оказывает также хороший эффект для снижения веса у пациентов с метаболическим синдромом.
Ожирения на фоне приёма иммуносупрессии: резюме и рекомендации.
Рекомендация 2.2
Физическая нагрузка и диета являются краеугольными камнями при повышения жировой массы тела после трансплантации печени.
Конкретные медицинские или хирургические вмешательства при ожирении после трансплантации печени могут рассматриваться индивидуально. Хирургические манипулции могут быть применены у пациентов с тяжелой формой ожирения, устойчивой к поведенческой модификации.Минимизация приёма ингибиторов кальциневрина и кортикостероидов рекомендуется для снижения риска развития ожирения после трансплантации печени.
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Коррекция дислипидемии на фоне приёма иммуносупрессии.
Дислипидемия наблюдается у 40-66% пациентов после трансплантации печени. Иммуносупрессивные препараты (ингибиторы калциневрина, ингибиторы mTOR, глюкокортикостероиды) могут провоцировать развитие дислипидемии. Тем не менее, необходимо проводить динамический контроль липидной панели натощак в течение года.
Важно рассматривать взаимодействие между ингибиторами HMGCoA редуктазы (статины) и ингибиторами кальциневрина, поскольку оба они метаболизируются цитохромом P450-3A4, что приводит к увеличению концентрации статинов, что может увеличить риск рабдомиолиза. Статины следует начинать с более низкой дозы и постепенно титровать. Гидрофильные статины, такие как флувастатин и правастатин, являются предпочтительными, поскольку они не метаболизируются цитохромом P450-3A (см. табл. 2)
Таблица 2. Взаимодействие антигипертензивных препаратов с иммуносупрессантами.
| Статины | Игибиторы АПФ | Антагонисты рецепторов к ангеотензину | Блокаторы кальциевых каналов | |
|---|---|---|---|---|
| Ингибиторы кальциневрина | Повышение концентрации статинов в крови | Повышает риск развития острой почечной недостаточности | Повышает риск развития острой почечной недостаточности | Повышение концентрации ингибиторов кальциневрина в крови |
| Ингибиторы mTOR | Не взаимодействуют | Повышает риск развития
ангионевротического отека
|
Не взаимодействуют | Повышение концентрации ингибиторов mTOR в крови |
| Антипролиферативные препараты | Не взаимодействуют | Не взаимодействуют | Не взаимодействуют | Не взаимодействуют |
Рекомендуется провести оценку риска атеросклеротической сердечно-сосудистой патологии (http://tools.acc.org/ASCVD-Risk-estimator/), а затем необходимо подобрать соответствующую терапии согласно категории риска.
Дислипидемия на фоне приёма иммуносупрессии: резюме и рекомендации.
Рекомендация 2.3
Скрининг: в течение года необходимо проводить скрининговый контроль уровня триглицеридов и липидной панели. Целевой уровень ЛПНП должен быть менее 100 мг/дл. Целевой уровень триглицеридов должен состовлять менее 250 мг/дл.
Лечение: все пациенты после трансплантации печени, у которых диагностирована дислипидемия, должны соблюдать диету и поддерживать определённый уровень активности. Если на протяжении 6 месяцев по данным анализов результат не достигнут, то необходимо назначать статины.
Предпочтительнее назначать правастатин, поскольку он не имеет выраженного лекарственного взаимодействия с ингибиторами калциневрина. Остальные статины должны назначаться в половинной дозировке от стандартной. Если пациент получает цилоспорин А, то приём статинов противопоказан.
Если дислипидемия развивается на фоне приёма циклоспорина, таких пациентов рекомендуется перевести на приём такролимуса.
Если дислипидемия развивается на фоне приёма ингибиторов mTOR, назначают препараты, снижающие уровень липопротеидов. Если на этом фоне эффект не достигнут, необходимо снизить дозировку ингибиторов mTOR или назначить другой иммуносупрессивный препарат.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Сахарный диабет на фоне приёма иммуносупрессии.
Сахарный диабет (СД) развивается по разным источникам до 26% случаев после трансплантации печени. Он является основным предиктором неблагоприятных исходов после трансплантации печени, таких как тромбоз печеночной артерии, отторжение трансплантата.
Если у пациента имеется сахарный диабет, который был ДО трансплантации печени, то его течение может ухудшиться после трансплантации.
Факторы, способствующие прогрессированию СД после трансплантации печени:
- иммуносупрессия;
- увеличение веса;
- денервация печени при трансплантации.
Цели коррекции СД аналогичны целям у пациентов без трансплантации, за исключением целевого значения гиликированного гемоглобина (HgbA1c) менее 7,0%. Важным аспектом в лечении СД является коррекция образа жизни пациента: диета и физическая нагрузка.
Такролимус и циклоспорин нарушают синтез и секрецию инсулина бета-клетками. Кортикостероиды могут способствовать резистентности к инсулину посредством увеличения глюконеогенеза, сниженем активности бета-клеток. Ингибиторы mTOR могут снизить пролиферацию бета-клеток и увеличить активацию GLUT-4.
Ранняя гипергликемия после трансплантации часто может быть скоррегирована путем минимизации поддерживающих иммуносупрессантов (кортикостероидов и ингибиторов кальциневрина).
Таблица 3. Аспекты лечения сахарного диабета после трансплантации печени.
| Препарат | Имеющиеся данные по пациентам, перенесших трансплантацию | Особенности |
|---|---|---|
| Метформин | Безопасно назначать при пересадке почки. | Предпочтительно применять с нормальной функцией почек. С осторожностью при острой/хронической почечной недостаточности (лактат-ацидоз). Противопоказан при сепсисе (выраженном инфекционном процессе). Можно применять при нарушении толерантности к глюкозе. |
| Препараты сульфонилмочевины | Эффективность не доказана. | вызывает гипогликемию на фоне острой/хронической почечной недостаточности и приёма ингибиторов кальциневрина. Глипизид или глимепирид предпочтительно назначать при почечной недостаточности. |
| Тиазолидиндионы | Безопасные и эффективные препараты. | Набор веса, развитие хронической сердечной недостаточности, потеря костной ткани. Эффективно при неалкогольном стеатогепатите. |
| Репаглинид | Безопасный и эффективный препарат, не взаимодействует с ингибиторами кальциневрина. | Риск развития гипогликемии со снижением клубочковой фильтрации (СКФ). |
| Ингибиторы ДПП-4 | Вилдаглиптин безопасен, эффективен. | Может понижать СКФ в зависимости от дозировки. |
| Агонисты GLP-1 | Малое количество наблюдений. | Тошнота, влияет на опорожнение желудка, перистальтику кишечника. Не применять при СКФ менее 40 мл/мин. |
| Ингибиторы SGLT-2 | Нет данных | Противопоказан. |
| Ингибиторы альфа-глюкозидазы | Нет данных | Противопоказан при снижении клубочковой фильтрации. |
Сахарный диабет на фоне приёма иммуносупрессии: резюме и рекомендации.
Рекомендация 2.4
Скрининг и мониторинг: Непереносимость глюкозы очень распространена после трансплантации печени. Все реципиенты печени сдавать глюкозу натощак и измерение гликированого гемоглобина, как минимум, 3-6 месяцев после трансплантации, затем через 1 год и ежегодно после этого. Целевой уровень гликированого гемоглобина должен быть <7,0%, скрининг на ретинопатию и протеинурию следует проводить ежегодно.
Лечение: Контроль питания, увеличение физической нагрузки и снижение дозировки кортикостероидов (вплоть до их отмены), являются наиболее важными изменяемыми факторами в ограничении воздействия посттрансплантационного СД. Лекарственная терапия после СД после транслантации печени соответствует стандартам оказания медицинской помощи при СД.
Конверсия с такролимуса на циклоспорин может улучшить контроль над диабетом и непереносимостью глюкозы .
Доказательность рекомендаций: умеренная;
Сила рекомендации: высокая.
Артериальная гипертензия на фоне приёма иммуносупрессии.
Артериальная гипертензия увеличивает риск сердечно-сосудистых заболеваний, хронических заболеваний почек и риск внезапной сердечной смерти. Распространенность гипертонии после трансплантации печени приближается к 70%, при этом пиковые подъёмы артериального давления случаются наиболее часто в раннем послетрансплантационном периоде, что, в первую очередь, связано с влиянием ингибиторов кальцинеприна на функцию почек. Ниже представлены рекомендации ILTS по лечению артериальной гипертензии у пациентов после трансплантации печени.
Таблица 4. Аспекты лечения артериальной гипертензии после трансплантации печени.
| Группа препаратов | Клинические рекомендации |
| Блокаторы кальциевых каналов | Амлодипин и нифедипин являются предпочтительными препаратами ввиду того, что они обладают эффектом, снижающим вазоконстрикцию при одновременном сочетании с ингибиторами кальциневрина. Не-дигидропиридиновые блокаторы кальциевых каналов — дилтиазем и верапамил не рекомендуются к применению из-за их склонности к взаимодействию с ингибиторами кальцневрина и увеличивают их резорбцию. |
| Бетта-блокаторы | Неспецифические бета-блокаторы являются препаратами второй линии, они эффективны также, как и блокаторы кальциевых каналов для лечения артериальной гипертензии у пациентов после трансплантации печени. |
| Ингибиторы АФП или блокаторы рецепторов к ангеотензину-2. | Эти препараты рекомендуются в качестве базисной терапии линии у пациентов после трансплантации печени. |
| Диуретики | Тиазидные и петлевые диуретики могут использоваться для устранения объемной перегрузки, связанной с применением ингибиторов кальциневрина и ингибиторов MTOR у пациентов после трансплантации печени. Следует обратить внимание: на фоне приёма этих препаратов могут быть электролитные нарушения, поэтому обязательно необходимо следить за электролитным составом периферической крови. |
Артериальная гипертензия на фоне приёма иммуносупрессии: резюме и рекомендации.
Рекомендация 2.5
Скрининг и мониторинг: артериальная гипертензия является распространенным нарушением после трансплантации печени. Все реципиенты печени должны проводить измерение уровня артериального давления как минимум, ежедневно в течение первого года после операции. Целевое артериальное давление: <130/80 мм рт.ст.
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Лечение: сочетание коррекции образа жизни и минимизации иммуносупрессии, особенно кортикостероидов и ингибиторов кальциневрина, являются важными изменяемыми факторами в механизме развития артериальной гипертензии. Меры в отношении коррекции образа жизни должны включать ограничение приёма в пищу соли, снижение массы тела, и проведение регулярных физических нагрузкок.
Доказательность рекомендаций: умеренная;
Сила рекомендации: высокая.
Раздел 3. Минимизация иммуносупрессии.
Все пациенты после трансплантации печени длительно получают иммуносупрессивную терапию. Поэтому подбор иммуносупрессивной терапии должен быть направлен на выявление соответствующего типа (ов) лекарственного средства и его дозировки, которая подавляет аллоиммунные реакции, одновременно минимизируя неблагоприятные последствия иммуносупрессии. Идентификация идеального режима иммуносупрессии для каждого отдельного пациента начинается во время трансплантации и основывается главным образом на клиническом представлении во время трансплантации и этиологии печеночной недостаточности.
Персонализацию иммуносупрессии можно рассматривать как корректировку протоколов иммуносупрессии, которые учитывают характеристики реципиентов, этиологию первичного заболевания печени и степень аллоиммунных реакций.
Стратегии минимизации иммуносупрессии наиболее безопасны при инициации в течение первых трёх послеоперационных месяцев и должны, в общем, рассматриваться в контексте биохимических показателей (печёночная панель), которые должны оставаться стабильными после очередной коррекции иммуносупрессивного протокола по меньшей мере в течение 4 недель.
Нет необходимости в выполнении биопсии печени перед началом минимизации иммуносупрессивной терапии. Если во время корректировки протоколов ухудшаются показатели биохимии печени, первым шагом является возврат к предыдущей дозе / или режиму иммуносупрессии. Если после возврата к предыдущему протоколу анализы не восстановились, рекомендуется выполнение биопсии печени для исключения реакции позднего отторжения. В целом, минимизация иммуносупрессии с клинической точки зрения возможна и безопасна.
Минимизация иммуносупрессии: резюме и рекомендации.
Рекомендация 3.1
Всем пациентам, перенесших трансплантацию печени, можно применять протоколы снижения иммуносупрессии.
Исключения:
- пациенты, у которых по данным биопсии, выявлено стероид-резистентное отторжение;
- пациенты, которым трансплантация печени выполнена по причине аутоиммунных заболеваний печени;
- пациенты, у у которых подтверждено антител-опосредованное отторжение (AMR).
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Отмена гормональных препаратов.
Спустя 3 месяца после трансплантации печени большинству пациентов можно снижать гормональную иммуносупрессию вплоть до полной отмены. Рекомендация заключается в медленном снижении дозы кортикостероидов с целью прекращения лечения. Как указано выше, у пациентов с более высоким иммунологическим риском (например, иммуно-опосредованными заболеваниями) следует учитывать либо поддержание низких доз стероидов в течение длительного времени, либо добавление микофенолатов (либо других групп иммуносупрессоров) для безопасной отмены стероидов.
Монотерапия ингибиторами кальциневрина.
Пациенты, которые в течение первых трёх месяцев после трансплантации печени оставались стабильными, и их анализы не вызывали претензий, являются кандидатами на монотерапию ингибиторами кальциневрина. Взрослым реципиентам, как правило, назначается такролимус пролонгированного действия. В противном случае, назначается такролимус обычного действия, в некоторых странах существуют протоколы приёма такролимуса обычного действия 1 раз в стуки (суточная доза) с целью улучшения комплаэнтности к лечению со стороны пациента.
Целевая концентрация такролимуса должна составлять 6-10 нг/мл.
Если препаратом выбора является циклоспорин, то рекомендуемый уровень концентрации должен составлять от 150 до 200 нг/мл.
С 3 по 12 месяц после трансплантации доза ингибиторов кальциневрина может медленно снижаться при регулярном контроле биохимических показателей. К концу первого года уровень такролимуса должны быть около 5 нг/мл, а уровень циклоспорина — около 100 нг/мл.
Начиная с 1-го года, концентрацию такролимуса можно снизить до 3 нг/мл. После 5-го года уровень лекарственного средства менее важен, если наблюдается хорошая функция трансплантата, о чем свидетельствуют стабильные и нормальные биохимические показатели. Однако полное прекращение иммуносупрессии должно быть ограничено клиническими испытаниями.
Переход с двухкомпонентного протокола иммуносупрессии на монотерапию.
Пациенты, получающие двухкомпонентный протокол иммуносупрессии, могут рассматриваться к переводу на монотерапию в любой момент времени после трансплантации печени (обычно> 1 год). Обязательное условия — низкий иммунологический риск.
В качестве монотерапии могут быть назначены:
- такролимус, с рекомендуемой концентрацией препарата около 5 нг/мл;
- эверолимус сс рекомендуемой концентрацией препарата от 3 до 8 нг/мл;
- микофенолаты в расчётной дозе (900*площадь поверхности тела), но не более 1440 мг в сутки для микофеноловой кислоты и не более 2000 мг в сутки для микофенолата миофетила).
ILTS также сообщает, что некоторые центры используют сиролимус у пациентов после трансплантации печени. Тем не менее, консенсусная группа не давала никаких рекомендаций по использованию сиролимуса, учитывая, что она не одобрена FDA и имеются другие альтернативы (everolimus).
Стратегии минимизации иммуносупрессии: резюме и рекомендации.
Рекомендация 3.2
Кортикостероиды: через 3 месяца после трансплантации печени большинству пациентов можно планово отменять кортикостероиды; пациентам с более высоким иммунологическим риском (например, имунно-опосредованные заболевания печени, стероид-резистентное отторжение) необходима поддерживающая терапия кортикостероидами или их замена на антипролиферативные препараты.
Ингибиторы кальциневрина: все пациенты, которые имеют показания к минимизации иммуносупрессии, являются потенциальными кандидатами на монотерапию ингибиторами кальциневрина уже через 3 месяца после трансплантации печени.
Переход на монотерапию: Пациентам, которые не переносят монотерапию ингибиторами кальциневрина или при более высоком иммунологическом риске, следует назначать двойной протокол иммуносупрессии, предпочтительно из следующих групп препаратов: ингибиторы калциневрина, микофенолаты или эверолимус .
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Раздел 4. Малигнизация и иммуносупрессия.
Малигнизация является одним из наиболее важных и опасных осложнений у реципиентов печени. Наиболее распространенными видами рака являются:
- немеланомный рак кожи;
- рецидивирующая гепатоцеллюлярная карцинома (ГЦК);
- не-ходжкинская лимфома;
- рак легких;
- рак почек.
Пациенты, которым пересадка выполнена по поводу алкогольного цирроза или первичного склерозирующего холангита, особенно подвержены риску малигнизации.
Модуляция иммуносупрессивных протоколов может изменить развитие специфических злокачественных опухолей, и наиболее широко признанными иммунодепрессантами в этой категории являются ингибиторы mTOR, которые имеют противоопухолевые эффекты. Фактически, ингибиторы mTOR одобрены для лечения некоторых злокачественных новообразований, включая нейроэндокринные опухоли, рак почек, астроцитому, рак поджелудочной железы и некоторые раковые опухоли молочной железы.
Иммуносупрессия и гепатоцеллюлярная карцинома.
Имеются некоторые данные, свидетельствующие о том, что высокий уровень иммуносупрессии может быть связан с более высокими показателями рецидива ГЦК. Более длительные курсы кортикостероидов и более высокие уровни ингибиторов кальциневрина связаны с повышенным риском рецидива.
Результаты ретроспективных исследований свидетельствуют о том, что ингибиторы mTOR, прежде всего сиролимус, уменьшают рецидив ГЦК примерно на 50%, и несколько метаанализов подтверждают эти данные.
Основываясь на этих многообещающих результатах, было проведено рандомизированное контролируемое исследование (РКИ) для изучения влияния сиролимуса на рецидив ГЦК. 525 реципиентов печени с ГЦК были отобраны для этого исследования. Несмотря на отсутствие различий в отсутствии рецидивов или общей выживаемости при приёме сиролимуса в конце исследования (8-й год), пациенты пациенты, которым трансплантация была выполнена в соответствии с миланскими критериями, и которым назначали сиролимус, имели меньший риск рецидива ГЦК и большую 5-летнюю выживаемость. Будут ли показаны схожие данные для препарата эверолимус, который одобрен для трансплантации печени, в отличие от сиролимуса, неизвестно.
Иммуносупрессия и рак кожи.
В ранних наблюдениях сообщалось о значительно меньшей заболеваемостью раком кожи кожи у реципиентов почки, которым назначался сиролимус. Эти результаты были подтверждены в метаанализе для реципиентов печени.
Иммуносупрессия и другие злокачественные новообразования.
Поскольку лечение злокачественных новообразований после трансплантации очень проблематично, кандидаты на трансплантацию пеечени проходят активный скрининг на злокачественные опухоли. Пациенты со злокачественными новообразованиями, как правило, не допускаются к трансплантации.
Малигнизация и иммуносупрессия: резюме и рекомендации.
Рекомендация 4.1
Гепатоцеллюлярная карцинома: помимо снижения общей иммуносупрессии, оптимальная стратегия иммуносупрессии для минимизации частоты и тяжести рецидива ГЦК, включая использование ингибиторов mTOR, не определена.
Рак кожи: имеются доказательства того, что сиролимус снижает риск рецидива рака кожи у пациентов с пересадкой почки. Оказывается ли тот же эффект при эверолимусе, который одобрен при трансплантации печени, неизвестен, но кажется вероятным.
Прочие злокачественные опухоли: нет прямых доказательств того, что ингибиторы mTOR предотвращают другие злокачественные новообразования у реципиентов печени, хотя есть вероятность положительного исхода у пациентов с нейроэндокринными опухолями или раком почки при приёме эверолимуса.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Раздел 5. Иммуносупрессия при трансплантации печени детям.
Иммуносупрессия в педиатрической практике несколько сложнее, нежели у взрослых реципиентов печени. Это связано с тем, что дети растут, часто болеют. Так же имеются определенные особенностей в фармакокинетике препаратов у детей. Все эти особенности усложняют ведение педиатрических реципиентов печени.
Индукционная иммуносупрессия в педиатрической практике.
Обзор центров, зарегистрированных в исследованиях по пересадке печени детям, показал, что более 90% используют такролимус, в качестве первичного иммуносупрессанта. Такролимус, как правило, предпочтительнее циклоспорина, поскольку последний обладает повышенной нефротоксичностью, может вызывать гирсутизм и гиперплазию дёсен. Также циклоспорин может иметь меньшую биодоступность, что связано с наличием билио-дигестивного анастомоза, обычно используемого у детей при выполнении трансплантации.
Большинство центров, которые занимаются педиатрической трансплантацией печени, используют индукцию такролимусом на 0-1 послеоперационные сутки в сочетании с внутривенным введением кортикостероидов.
Треть международных центров используют индукционную терапию либо антагонистами рецепторов IL-2, либо анти-тимоцитарным глобулином. При индукционной терапии введение такролимуса может быть отложено до 3-5 послеоперационных суток.
Поддерживающая иммуносупрессия в педиатрической практике.
Ингибиторы кальциневрина обеспечивают высокоэффективную иммуносупрессию после трансплантации печени. Оптимальная концентрация таколимуса составляют 8-12 нг/мл в течение 0-3 месяцев после трансплантации, 6-10 нг/мл через 3-6 месяцев и приблизительно 5-7 нг/мл через 6 месяцев после трансплантации.
Кортикостероиды следует отменять в течение первых 12 месяцев, если это необходимо. Цель большинства центров — достичь монотерапии такролимусом в течение одного года после трансплантации печени. Большинство опрошенных центров установило строгий мониторинг, если иммуносупрессия еще более агрессивно сведена к минимуму.
Лекарственный контроль после трансплантации печени детям.
Множественные факторы влияют на концентрацию препаратов у детей. Этими факторами являются возраст, путь введения препарата, лекарственная форма препарата, функция трансплантата, взаимодействие с лекарственными средствами и подвижность кишечника (перистальтика).
На стационарном лечении, контроль концентрации препаратов необходимо проводить со следующими интервалами:
- Ингибиторы кальциневрина — каждые 2-4 приёма (каждые 2-3 дня);
- Ингибиторы mTOR — каждые 5-8 дней;
- Эверолимус- каждые 2-3 дня;
- Микофенолаты — не нуждаются в контроле.
Подбор иммуносупрессии основываясь на исходном диагнозе (причине цирроза).
Более агрессивные схемы индукции после трансплантации могут быть оправданы для пациентов с более высоким иммунологическим риском, например: ABO несовместимые трансплантации, ретрансплантация по поводу острого отторжения или положительный cross-match тест.
Напротив, центры часто избегают агрессивной индукции для пациентов, которые в настоящее время или ранее имели злокачественные опухоли или у пациентов с острой печеночной недостаточностью.
В некоторых центрах для пациентов с аутоиммунным заболеванием печени используются антипролиферативные перпараты, такие как микофенолаты или азатиоприн в сочетании с ингибиторами кальциневрина. Применение ингибиторов mTOR в качестве предполагаемых противоопухолевых агентов описано для пациентов с посттрансплантационными лимфопролиферативными расстройствами и другими злокачественными новообразованиями, такими как гепатобластома.
Комплаэнтность пациентов и их родственников.
Строгое соблюдения режима дозирования иммуносупрессии всегда является центральной проблемой в педиатрической трансплантации, поскольку, зачастую, родители или опекуны пациента могут быть не комплаэнтны. Преднамеренное или непреднамеренное несоблюдение режима приёма лекарств может приводить к дисфункции трансплантата или к другим осложнениям.
Комплаэнтность может быть оценена по показаниям пациента / семьи, пополнению и подсчету количества таблеток, концентрации иммуносупрессии и биохимическим показателям крови.
Депрессия, посттравматическое стрессовое расстройство, жестокое обращение с детьми, импульсивность и невнимательность, плохая внутрисемейная атмосфера и отсутствие социальной поддержки могут способствовать несоблюдению режима приёма препаратов. В таких случаях необходимо, чтобы на помощь приходили специалисты в области психического здоровья и социальной помощи.
Также, к факторам несоблюдения режима приёма препаратов относятся:
- лекарственная форма препарата;
- вкусовые качества препарата;
- стоимость препарата;
- частота и сроки приема лекарств;
- мужской пол;
- небелая раса / этническая принадлежность;
- подростковый период.
Приверженность к приёму препаратов должна постоянно решаться с помощью открытого общения с пациентом. Инструкции по приёму препаратов должны быть последовательными, простыми и практичными. Было показано, постоянные и регулярные беседы с пациентом, система позитивного подкрепления, а так же напоминания (будильник) может способствовать упрощению режима дозирования препаратов для пациентов.
Иммуносупрессия при трансплантации печени детям: резюме и рекомендации.
Рекомендация 5.1
Такролимус является препаратом выбора для первичной и поддерживающей иммуносупрессии после трансплантации печени.
Если индукционная терапия проводилась используется сразу же после трансплантации печени, инициация терапии ингибиторами кальциневрина может быть отложена, как правило, на срок до 4-5 дней. Индукционная терапия сопровождаемая немедленным введением ингибиторов кальциневрина и антипролиферативными препаратами показана пациентам с высоким иммунологическим риском.
Ингибиторы mTOR могут играть важную роль у пациентов с предшествующим или активным онкологическим процессом.
Рекомендуется в течение первого года после трансплантации переходить на монотерапию такролимусом (по показаниям).
Приверженность к приёму препаратов должна решаться с помощью открытого общения с пациентом или с его опекунами, а использование технологий для напоминания о приёме препаратов необходимо вводить повсеместно.
Доказательность рекомендаций: умеренная;
Сила рекомендации: высокая.
Раздел 6. Иммуносупрессия у пациентов с почечной недостаточностью.
Оценка функции почек у кандидатов на трансплантацию печени.
Диагностика и постановка острой почечной недостаточности (ОПН) у пациентов с заболеваниями печени должна основываться на клиренсе креатинина сыворотки крови.
Хроническая болезнь почек (ХБП) определяется как отклонения в структуре почек (протеинурия, аномальный осадок мочи, гистология почек и/или почечная недостаточность) или снижение скорости клубочковой фильтрации (СКФ) в течение 3 месяцев. ХБП следует классифицировать по степени тяжести в соответствии с данными в таблице №5.
Таблица 5. Классификация хронической болезни почек.
| ХБП (Степень) | Скорость клубочковой фильтрации (mL/min/1.73 m^2) |
| 1 |
≥90 |
| 2 |
60-89 |
| 3a |
45-59 |
| 3b |
30-44 |
| 4 |
15-29 |
| 5 |
<15 |
Хотя значения креатинина используются для начальной оценки функции почек, их следует интерпретировать с осторожностью у пациентов, перенесших трансплантацию печени,потому что необходимо будет переоценить скорость клубочковой фильтрации, особенно у пациентов с недоеданием и перегрузкой по жидкости.
Оценка функции почек: резюме и рекомендации.
Рекомендация 6.1
Перед трансплантацией необходимо использовать уравнение MDRD-6 для определения оценочной скорости клубочковой фильтрации.
После третьего послеоперационного месяца следует использовать уравнение MDRD-4, 6 или CKD-EPI для определения оценочной скорости клубочковой фильтрации.
Данные уравнения следует использовать осторожно для оценки функции почек у этой популяции пациентов, поскольку они склонны переоценивать СКФ. Возможно потребуется использовать дополнительные формулы для измерения СКФ и высчитывать среднее значение.
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Влияние почечной недостаточности на исход трансплантации печени.
Дисфункция почек встречается у 50% амбулаторных пациентов с декомпенсированным циррозом и 20-25% госпитализированных пациентов с циррозом печени. Частота смертности, инфекций и осложнений, связанных с циррозом, возрастает с тяжестью почечной недостаточности.
Во время трансплантации 20-25% пациентов имели СКФ <30 мл/мин/1,73 м2. Заболеваемость ОПН после трансплантации печени колеблется от 17 до 94% по разным источникам. Чем выше тяжесть почечной недостаточноси и потребности в заместительной почечной терапии, тем выше возрастает смертность после трансплантации печени. Причины ОПН связаны с нарушениями гемодинамики, первичной дисфункции трансплантата, использование нефротоксических препаратов и ушивание полой вены.
После трансплантации печени кумулятивная частота ХПН 3 стадии и выше колеблется от 36-57%. Пациенты с ХПН 4 стадии и выше имеют повышенный риск смерти. Общая частота возникновения ХПН после трансплантации печени через 5 лет у пациентов с MELD <20 и у пациентов с MELD> 20 при составила 17% и 37% соответственно.
Наиболее частой причиной развития дисфункции почек является приём ингибиторов кальциневрина. Другими дополнительными факторами являются мембранопролиферативный гломерулонефрит, сахарный диабет, нефропатия IgA, острый тубулярный некроз.
Индукционная иммуносупрессия у пациентов с почечной недостаточностью.
Ранний послеоперационный период
Схемы на основе ингибиторов кальциневрина являются причиной почечной дисффункции от 13% до 33% случаев в зависимости от того, вводятся ли ингибиторы кальциневрина отдельно или в сочетании с антиметаболитами или индукционной терапией. В двух крупнейших рандомизированных контролируемых исследованиях (исследования Respect and Diamond) индукционная терапия проводилась препаратом анти-IL-2R в комбинации с микофенолатами и с начальной низкой дозой пролонгированного такролимуса или отсроченным введением такролимуса. Данные исследования показали значительное улучшение функции почек.
В отсутствие комбинированной терапии с микофенолатами, уровень концентрации в течение первого месяца после трансплантации, варьируется от 8 до 15 нг/мл.
В более поздних исследованиях с использованием индукционной терапии и / или в комбинации с микофенолатами уровень концентрации такролимуса в течение первого месяца варьировался от 6 до 8 нг/мл с аналогичной частотой отторжений.
Мета-анализ двух РКИ показал, что при почечной недостаточности (n = 712), уменьшение концентрации таколимуса (<10 нг / мл) в течение первого месяца после трансплантации снижает риск возникновения почечной недостаточности по сравнению с обычной концентрацией такролимуса (> 10 нг / мл).
Ранние исследования показали, что использование сиролимуса в раннем послеоперационном периоде было связано с высокой частотой печеночных артериальных тромбозов, потерей трансплантата и смертью, ввиду этого, препарат крайне не рекомендована для индукционной иммуносупрессии.
Индукционная иммуносупрессия и почечная недостаточность: резюме и рекомендации.
Рекомендация 6.2
Индукционная терапия препаратом анти-IL-2R в комбинации с микофенолатами и с начальной низкой дозой пролонгированного такролимуса или отсроченным введением такролимуса показывает наилучший эффект по предотвращению почечной недостаточности после трансплантации печени.
Доказательность рекомендаций: умеренная;
Сила рекомендации: высокая.
Средний и долгосрочный послеоперационные периоды.
На данный момент нет чёткого определения среднего и долгосрочного послеоперационного периода после трансплантации печени. Однако, принимая во внимание изменения приёма и дозирования иммуносупрессивных препаратов, среднесрочный период можно рассматривать в течение 1-6 месяцев после трансплантации и долгосрочный ≥ 1 года после трансплантации печени.
Рекомендация 6.3
Раннее назначение эверолимуса в течение первого в сочетании с низкими дозами такролимуса ( концентрация ≤ 5 нг / мл) приводит к значительно лучшей почечной функции, чем при стандартном дозировании такролимуса. Эта стратегия особенно полезна у пациентов с хроническим заболеванием почек (ХБП>= 3, СКФ 60 мл/мн/1,7 м^2).
Доказательность рекомендаций: высокая;
Сила рекомендации: высокая.
Рекомендация 6.4
Снижение дозировки ингибиторов кальциневрина должна быть предпринята у пациентов с ХБП в конце раннего послеоперационного периода. Позднее (> 1 год) назначение ингибиторов mTOR оказывает нечеткое влияние на функцию почек, особенно у пациентов с ХБП ≥ 3.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Симультанная трансплантация печени и почки.
У пациентов с одновременной трансплантацией печени и почки острое клеточное отторжение и антител-опосредованное отторжение случаются довольно редко. Тем не менее, трансплантаты печени могут не полностью защищать почечный аллотрансплантат, особенно с наличием предшествующих антител.
В серии из 140 реципиентов печень+почка с долгосрочным наблюдением пограничное клеточное, острое клеточное, антител-опосредованное и хроническое отторжение почек наблюдались у 11,4%, 6,4%, 1,4% и 0,7% пациентов соответственно. Острое клеточное и хроническое отторжение печени были диагностированы у 11,4% и 2,9% пациентов соответственно.
Taner et al. также сообщали, что у таких реципиентов по сравнению с реципиентов трансплантата почки моно ассоциируется с более редким возникновением хронического клеточного и антител-опосредованного отторжения.
Рекомендация 6.5
Индукционная терапия при симультанной трансплантации печени и почки, например, антитимоцитарным глобулином, может быть рассмотрена у пациентов с высокой иммунологической активностью (положительный кросс-матч, высокие уровни предшествующих антител). Индукционная терапия также может быть рекомендована пациентам с отстроченной функцией почечного трансплантата с целью задержки и / или минимизации использования ингибиторов кальциневрина.
Ингибиторы кальциневрина, в идеале — такролимус, в сочетании с кортикостероидами и микофенолатами, рекомендуются в качестве поддерживающей поддержания иммуносупрессии у реципиентов печени и почки.
Доказательность рекомендаций: умеренная;
Сила рекомендации: условная.
Резюме.
В данной статье была рассмотрена иммуносупрессивная терапия у реципиентов печени. Данные клинические рекомендации были сформированы на основании метанаализов 173 источников. Дата выхода рекомендаций — 2018 г. По мере поступления новых рекомендаций данная статья будет дополняться.





Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!