Роль эндоваскулярных и эндобилиарных методов в лечении осложнений после трансплантации печени
является признанным методом лечения пациентов с терминальной стадией заболеваний печени или острой печеночной недостаточностью. Однако сосудистые осложнения, такие как стеноз и/или тромбоз печеночной артерии, стеноз воротной вены трансплантата и билиодигестивные стриктуры, после трансплантации печени все еще часто встречаемы, несмотря на улучшения и инновации в хирургических методах. Данные осложнения могут приводить к повреждениям трансплантата или даже к летальному исходу. Этиология данных осложнений является многофакторной. Хотя малоинвазивная интервенционная радиология для лечения данных осложнений после трансплантации печени является опциональным вариантом лечения, существует достаточно малое количество проведенных исследований данного метода лечения.
Введение.
Содержание статьи:
В соответствии с рекомендациями Американской ассоциации по изучению заболеваний печени и Американского общества трансплантологии предлагается регулярно и рутинно проводить скрининг и обнаружение хирургических осложнений после трансплантации печени. Хирургические осложнения, такие как стеноз и тромбоз печеночной артерии, стеноз воротной вены и билиодигестивные стриктуры, оптимально диагностируются и лечатся в трансплантологическом центре, однако нет единого мнения относительно мониторинга этих осложнений и тактики их лечения.
Исторические аспекты развития малоинвазивных методов лечения.
Начало развития катетерной техники относится к глубокой древности. Древние египтяне, за 3000 лет до н. э., впервые в мире выполнили катетеризацию мочевого пузыря, используя специальные трубки. Erasistratus впервые около 300 года до н. э. использовал слово «καθετηρ» (катетер) для описания этого инструмента. Классические S-образные катетеры датируются этим периодом, и некоторые из них были обнаружены при раскопках дома хирурга в Помпеях, который был похоронен извержением вулкана в 79 году н. э.
В 1711 г. голландский физиолог Н. Hales выполнил первую катетеризацию камер сердца у лошади с помощью трубок из латуни и стекла. Важнейшее открытие для дальнейшего развития медицины сделал W. Roentgen в 1895 г., открыв излучение, названное им Х-лучами.
А уже в 1896 г. В.М. Бехтерев предсказал открытие ангиографии:
«…Раз стало известно, что некоторые растворы не пропускают лучи Рентгена, то сосуды мозга могут быть заполнены ими и сфотографированы in situ».
Годом возникновения интервенционной радиологии можно считать 1929-й. W. Forssman, 25-летний резидент-хирург больницы Красного Креста Auguste Viktoria Home в Эберсвальде (Германия), в эксперименте впервые в мире доказал безопасность введения катетеров в сердце человека, когда сам себе провел катетер через локтевую вену в полость правого предсердия. В 1953 году шведский врач S. Seldinger впервые применил метод пункционного доступа в артерию Сельдингера, которым заложил основы современной интервенционной радиологии В 1958 г. детский кардиолог в клинике Кливленда (США) М. Sones впервые зафиксировал рентгеноконтрастное изображение коронарных артерий на кинопленку при выполнении аортографии. Первую селективную коронарографию в СССР выполнили в 1971 г. Ю.С. Петросян и Л.С. Зингерман в Институте сердечно-сосудистой хирургии им. А.Н. Бакулева АМН СССР. В 1977 г. A. Gruentzig и R. Myler в госпитале St. Mary’s в Сан-Франциско (США) выполнили первую коронарную баллонную ангиопластику у человека. Первую в СССР процедуру коронарной баллонной ангиопластики выполнили И.X. Рабкин и А.М. Абугов во Всесоюзном научном центре хирургии в 1982 г.
Конец XX века стал эпохой расцвета эндоваскулярной хирургии, методы которой стали применяться и в других областях медицины. Bjerkvik et al. в 1989 году описали случай чрескожной реваскуляризации трансплантата путем транскатетерного фибринолиза у одного пациента с тромбозом печеночной артерии (ТПА). Однако в этом случае понадобилось проведение баллонной ангиопластики (БА). При лечении раннего ТПА роль фибринолиза оставалась и остается спорной. Hidalgo et al. в 1995 году достигли хороших результатов с использованием урокиназы для локального фибринолиза у двух пациентов с ранним ТПА; однако после фибринолиза обоим пациентам также потребовалась дополнительная БА. Ангиопластика и стентирование воротной вены были впервые описаны в 1990 году Olcott et al. в Калифорнийском университете, Сан-Франциско (США). Raby et al. впервые предложили портальную ангиопластику у детей; в последующие годы эта техника стала методом выбора при посттрансплантационном портальном стенозе c хорошими результатами и низкой частотой осложнений после процедуры. В 2001 году Schwarzenberg et al. из Миннесотского университета (США), доложили о положительных результатах купирования билиодигестивных стриктур. Шести пациентам после развития стриктуры билиодигестивного анастомоза была выполнена баллонная дилатация анастомотического стеноза и установка наружно-внутреннего дренажа.
Стеноз и/или тромбоз печеночной артерии после трансплантации печени.
Нарушения артериального кровотока включают в себя тромбоз печеночной артерии (ТПА), стеноз печеночной артерии (СПА), патологическую извитость (кинкинг) печеночной артерии (КПА), а также синдром артериального «обкрадывания» печеночного трансплантата. В зависимости от временного интервала между трансплантацией печени и ТПА можно выделить ранний ТПА (до 4 недель) и поздний ТПА (более 4 недель после трансплантации). Bekker et al. выполнили систематический литературный обзор, который показал, что частота ранних ТПА у детей после трансплантации печени составляет 8,3%, в то время как у взрослых 2,9%. Своевременная диагностика и лечение ТПА может предотвратить повреждение билиарного тракта и паренхимы трансплантата печени.
Факторы риска развития стеноза и/или тромбоза печеночной артерии трансплантата.
Факторы риска со стороны донора.
Нетипичная артериальная анатомия печени со стороны донора является фактором риска, особенно в случаях несоответствия «калибров» при формировании артериального анастомоза трансплантата печени. Что касается индекса отношения массы трансплантата к массе тела реципиента (GRWR), данные, полученные при различных исследованиях, все еще остаются дискутабельными. Sanada et al. [19] сообщили, что трансплантаты с GRWR <1,1% являются фактором риска развития тромбоза печеночной артерии. По данным исследования Li et al., трансплантаты с GRWR ≥4% достоверно связаны с развитием ТПА при родственной трансплантации печени у детей. Однако Uchida et al. показали, что трансплантаты с GRWR ≥4% могут безопасно использоваться в педиатрической трансплантации. Кроме того, важным фактором риска развития СПА и/или ТПА являются дефекты хирургической техники при изъятии трансплантата.
Факторы риска со стороны реципиента.
Uchida et al. также провели анализ факторов риска развития нарушений артериального кровотока трансплантата печени. Было установлено, что женский пол, малый вес и высокий индекс веса трансплантат/реципиент (GRWR) были связаны с риском развития ТПА. Спорным вопросом остается малая масса реципиента как фактор риска тромбоза. В нескольких исследованиях сообщалось, что масса тела реципиента не является фактором риска развития тромбоза печеночной артерии. В то же время Desai et al. обнаружили, что риск развития тромбоза печеночной артерии выше у пациентов с массой тела менее 10 кг. Нетипичная артериальная анатомия реципиента также является фактором риска развития СПА и/или ТПА.
Дооперационные факторы.
По данным исследования Uchida et al., длительное время холодовой ишемии и длительное время тепловой ишемии были факторами, ведущими к ТПА. Однако, по данным Organ Transplantation Center в городе Тяньцзинь (Китай), не было выявлено связи между высоким риском ТПА и пролонгированной холодовой ишемией.
Интраоперационные факторы.
Что касается факторов риска трансфузии, Uchida et al. доложили, что более 6 доз эритроцитарной взвеси и/или трансфузия более 15 доз свежезамороженной плазмы во время операции являются факторами риска развития ТПА. Приоритет в использовании микроскопа, а не обычной хирургической оптики во время формирования анастомоза печеночной артерии не изменяет частоту возникновения тромбоза печеночной артерии, по мнению некоторых авторов. Backes et al. сообщили, что использование сосудистой вставки при формировании анастомоза печеночной артерии является полезной опцией при трансплантации печени у детей. Однако, напротив, Duffy et al. сообщили, что использование сосудистой вставки является серьезным независимым фактором риска развития тромбоза печеночной артерии. Использование множественных анастомозов печеночной артерии не оказало никакого влияния на развитие СПА и/или ТПА в исследованиях Julka et al. и Uchida et al. Тем не менее SedaNeto et al. обнаружили защитный эффект при формировании двух артериальных анастомозов от развития тромбоза. Также фактором риска ТПА является вторичный отек трансплантата печени вследствие ишемического-реперфузионного «удара».
Послеоперационные факторы.
Группа авторов считает, что наличие у реципиента после трансплантации СПА и КПА является инициирующим фактором развития ТПА. Раннее назначение аспирина также показало свою эффективность в качестве профилактики тромбоза печеночной артерии.
Диагностика стеноза и/или тромбоза печеночной артерии после трансплантации печени.
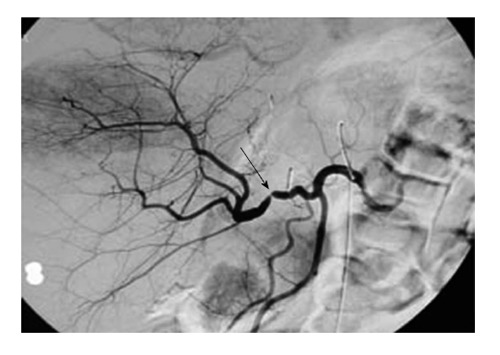
Как правило, клиническая картина СПА и/или ТПА включает в себя умеренное повышение уровней сывороточных трансаминаз и билирубина (75%), билиарные осложнения (15%), лихорадку и сепсис (6%), дисфункцию или печеночную недостаточность (4%). Клиника ТПА может представлять собой как лишь изолированное повышение маркеров ферментов цитолиза, так и картину сепсиса вследствие тяжелой дисфункции трансплантата. Наиболее часто СПА и/или ТПА выявляют при ультразвуковой доплерографии с последующей КТ- ангиографией. В некоторых исследованиях ультразвуковая доплерография показала чувствительность 92–100%, специфичность 99,5%. Ультразвуковыми признаками СПА и/или ТПА по данным доплерографии считаются: пиковая систолическая скорость по печеночной артерии менее 20,0 см/с или индекс резистентности менее 0,6 дистальнее области анастомоза. Тем не менее «золотым стандартом» диагностики СПА и/или ТПА, по мнению абсолютного большинства исследователей, является ангиография.
Методики выполнения малоинвазивной коррекции стеноза и/или тромбоза печеночной артерии.
Исследование Chen et al., а также исследования Yanaga et al. продемонстрировали, что срочная реваскуляризация в случаях раннего ТПА после трансплантации печени может значительно снизить потерю трансплантата и устранить необходимость в ретрансплантации. Результаты вышеупомянутых исследований показали, что ранняя реваскуляризация добивается 55% восстановления трансплантата, тогда как поздняя реваскуляризация была неудачной в 100% случаев.
Sanada et al. в 2018 году представили обширное ретроспективое исследование. С мая 2001 года по сентябрь 2016 года 279 родственных трансплантаций печени были выполнены у 271 ребенка. Посттрансплантационные осложнения печеночной артерии были обнаружены в 15 случаях (5,4%), включая ТПА и СПА в 14 (5,0%) случаях и окклюзию в результате сдавления жидкостным скоплением в одном случае (0,36%). Малоинвазивная коррекция была первой линией лечения в семи случаях (46,7%). Успех в случаях применения малоинвазивной методики при СПА и/или ТПА составил 100%. Кроме того, в настоящем исследовании выживаемость трансплантата у пациентов с сосудистыми осложнениями составила 94,4%. Методики выполнения эндоваскулярной коррекции СПА и/или ТПА достаточно широко используются у взрослых пациентов после трансплантации печени много лет, однако, что касается педиатрической практики, данные малоинвазивные способы лечения осложнений слабо транспонированы.
Синдром артериального «обкрадывания» печеночного трансплантата.
Артериальная гипоперфузия трансплантата печени при отсутствии окклюзии печеночной артерии впервые описана Langer et al. в 1990 г. Более чем в 80% диагностированных случаев данное осложнение встречается в раннем послеоперационном периоде. Ангиография является «золотым стандартом» диагностики синдрома «обкрадывания» селезеночной артерией. Диагноз определяется редуцированным кровотоком по печеночной артерии при отсутствии значительных артериальных анатомических дефектов, таких как СПА, ТПА или КПА. Тщательная оценка ангиографии чревного ствола с целью выявления лежащих в основе сосудистых дефектов (СПА, ТПА или КПА) является первым шагом. Эмболизация селезеночной артерии считается методом выбора смещения гемодинамического баланса в пользу трансплантата печени, а также уменьшения гипердинамического портального кровотока.
Стеноз воротной вены после трансплантации печени.
Интервенционная радиология в настоящее время широко используется и считается безопасным и эффективным методом лечения стенозов воротной вены (СВВ) печеночного трансплантата. Funaki et al. сообщили, что баллонная ангиопластика воротной вены для лечения СВВ имела частоту рецидивов 50% в среднем за 6,3 месяца, в то время как стентирование показало 100% проходимость воротной вены в течение 47 месяцев наблюдения. Нарушения портального притока после трансплантации печени могут быть классифицированы как ранние (обнаруженные в течение 3 месяцев после трансплантации) или поздние (обнаруженные более чем через 3 месяца после трансплантации печени).
Что касается тромбозов воротной вены, эндоваскулярные методы не демонстрируют должной эффективности. В случаях раннего портального тромбоза надлежащим методом лечения является открытая тромбэкстракция, а в случаях позднего портального тромбоза – формирование мезентерико-портального шунтирования (Meso-Rex) шунта. Частота развития СВВ у взрослых пациентов в случаях выполнения ортотопической трансплантации целой печени достаточно низкая. Наиболее частым показанием к трансплантации печени у детей является билиарная атрезия, при данном заболевании у пациентов достаточно часто встречается гипоплазия воротной вены. Данный фактор провоцирует развитие СВВ, а также усложняет формирование портального анастомоза ввиду несоответствия «калибров» донорской портальной вены и портальной вены реципиента.
Факторы риска развития стеноза воротной вены.
Факторы риска развития осложнений со стороны портальной вены: технические сложности формирования анастомоза, ранний возраст, масса тела <6 кг, диаметр портальной вены реципиента <3,5 мм, ротация трансплантата, симультанная тромбэктомия предсуществующего тромбоза воротной вены и использование сосудистых кондуитов для портальной реконструкции.
Некоторые хирургические техники могут играть важную роль в предотвращении СВВ, особенно при родственной трансплантации печени или сплит- трансплантации печени. Для преодоления несоответствия калибров портальных вен донора и реципиента использование «фактора роста» при сосудистом шве оказалось действенным методом.
Другим методом является обеспечение адекватного притока крови – лигирование мелких портальных ветвей со стороны реципиента. Использование больших трансплантатов может спровоцировать компрометацию кровотока при закрытии брюшной полости, что может привести к тромбозу сосудов. В этом случае используется отложенное закрытие передней брюшной стенки для исключения резкого роста внутрибрюшного давления.
Диагностика и лечение стеноза воротной вены после трансплантации печени.
Клинические проявления СВВ варьируют от бессимптомного течения до выраженных симптомов, включая массивный асцит, анемии, стойкую спленомегалию с или без тромбоцитопении и желудочно- кишечные кровотечения. Число тромбоцитов может быть ниже нормы вследствие гиперспленизма у пациентов со стенозом портальной вены. Стеноз воротной вены обычно выявляют при рутинной доплерографии, КТ или МРТ.
В настоящее время широко используются два типа эндоваскулярных подходов. Антеградный метод – доступ к СВВ осуществляется через систему брыжеечных вен, из мини-доступа. Вторым подходом, менее инвазивным, считают ретроградный метод – доступ к ветвям воротной вены осуществляется путем чрескожной чреспеченочной пункции данных ветвей под ультразвуковым контролем.
Среди исследователей данного осложнения существует также «противостояние» методов непосредственно коррекции стеноза – достаточно ли проведения баллонной ангиопластики или же стентирование – это необходимая опция лечения СВВ. Sakamoto et al. и Bertram et al. продемонстрировали, что баллонная ангиопластика – эффективный и относительно безопасный метод лечения СВВ, однако, у 28–50% пациентов после процедуры развивается рецидив СВВ. В данных исследованиях предлагается стентирование и/или повторные баллонные ангиопластики для решения этой проблемы. Cheng et al. сообщили об эффективности метода стентирования при СВВ у взрослых и детей. Процент проходимости стента составил 90,9% за средний период наблюдения 12 месяцев.
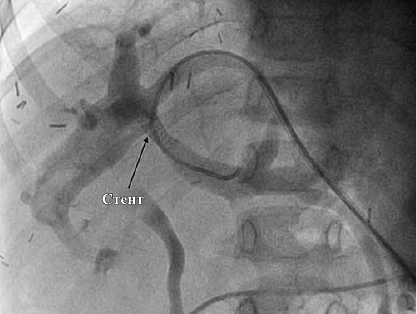
Напротив, другие исследования выразили озабоченность по поводу побочных эффектов стентирования. Эти побочные эффекты включают гиперплазию мембраны интимы, несоответствие размеров во время повторной трансплантации, а также возможность миграции стента. В 2019 году Katano et al. в Медицинском университете города Джичи (Япония) представили обширное ретроспективное исследование. 282 детям была проведена родственная трансплантация печени. Портальные осложнения произошли в 40 (14,2%) случаях. В 36 случаях была выполнена баллонная ангиопластика и в 4 случаях – стентирование воротной вены. Частота рецидивов после баллонной ангиопластики составила 27,5%. Степень проходимости стентов составляла 100%.
В 2017 году в Южной Корее было также проведено крупное совместное исследование Больницы св. Марии (Ичхон) и медицинского центра Асан (Сеул). У 55 (18,6%) пациентов из 296 развился СВВ. 12 пациентам была выполнена баллонная ангиопластика и 41 пациенту – стентирование. Успех при баллонной ангиопластике был достигнут в 89% случаев. Рецидивы произошли у 3 (25%) пациентов. Стентирование выполнялось в случаях, если после ангиопластики развернутый баллон демонстрировал деформацию талии >50% или градиент давления в воротной вене был >5 мм рт ст. Удовлетворительный портальный кровоток наблюдался у всех пациентов, перенесших стентирование. 1-, 5- и 10-летние коэффициенты первичной проходимости стента составляли 90 ± 7%, 90 ± 7% и 85 ± 8% соответственно.
Билиодигестивные стриктуры после трансплантации печени.
Желчные стриктуры и желчные свищи являются наиболее частыми ранними посттрансплантационными осложнениями, риск развития которых 10–30% по разным данным. Билиарные стриктуры классифицируются в анастомотические (АС) или неанастомотические стриктуры (НАС).
Факторы риска развития билиодигестивных стриктур после трансплантации печени.
Факторами риска развития БС являются: время холодовой ишемии трансплантата печени, нарушение артериального кровоснабжения трансплантата, отторжение и цитомегаловирусная (ЦМВ) инфекция.
Несколько авторов предоставили исследования, доказывающие взаимосвязь возникновения БС с предсуществующими артериальными осложнениями. Так, по данным, полученным Darius et al., тромбоз печеночной артерии увеличивал риск анастомотических БС у детей (p < 0,001). В 2018 году Fang-Min Liao et al. продемонстрировали, что у детей после трансплантации печени с индексом резистентности печеночной артерии по данным доплерографии ≤0,57 более высокий риск возникновения БС (p = 0,001). Feier et al. в 2016 доложили о том, что наличие нескольких артериальных анастомозов может «защитить» ребенка от развития билиарных стриктур.
Диагностика и лечение билиодигестивных стриктур после трансплантации печени.
Клинически стриктуры желчевыводящих путей следует подозревать у пациентов с признаками холестаза или эпизодами холангита. Однако у большинства пациентов наблюдается неспецифическая клиническая картина, а также дискретные изменения уровня ферментов печени. Ультразвуковое исследование обычно не выявляет значительных изменений, в то время как магнитно-резонансная холангиография, инструмент, превосходящий ультразвуковой контроль, является приоритетным методом в неинвазивной инструментальной диагностике данного осложнения. Чрескожная чреспеченочная холангиография играет решающую роль в диагностике билиарной стриктуры у реципиентов печени, поскольку считается золотым стандартом для выявления и количественной оценки стеноза.
Чрескожная чреспеченочная билиопластика (ЧЧБП) – малоинвазивный метод и имеет успех в диапазоне от 34 до 75%, результаты аналогичны результатам при хирургической ревизии. Основным недостатком ЧЧБП является потенциальная необходимость в длительном наружном желчном дренировании и повторных процедурах с потенциальными психологическими последствиями. Belenky et al. рекомендовал в случаях поздних билиодигестивных стриктур размещение стента как приоритетную опцию лечения. Данный метод показывает долгосрочные результаты, превосходящие результаты, полученные при изолированной дилатации баллонными катетерами.
Нет больших когортных или рандомизированных контролируемых исследований для сравнения краткосрочных и отдаленных результатов ЧЧБП и операций, и в большинстве опубликованных исследований доступны только краткосрочные или среднесрочные наблюдения.
Кроме того, в разных центрах используются разные методы и/или терапевтические алгоритмы, что затрудняет сравнение результатов и осложнений, о которых сообщается в литературе. В 2008 году Miraglia et al. сообщили о результатах ЧЧБП у 20 детей, перенесших трансплантацию печени в период между 2004 и 2007 годами. Стриктура желчных анастомозов была успешно пройдена у всех пациентов, после чего ЧЧБП была выполнена без серьезных осложнений. Среднее число выполненных баллонных дилатаций составило 4, а средняя продолжительность установки холангиостомических дренажей составила 5 месяцев. У 28% развился повторный стеноз, для которого потребовалась вторая серия проведения ЧЧБП.
Нормализация ферментов печени и разрешение внутрипеченочной дилатации желчевыводящих путей являются конечными точками, используемыми для определения технического успеха в самых последних сериях, касающихся ЧЧБП или хирургической реконструкции стриктур желчевыводящих путей.

Заключение.
В случаях развития осложнений после трансплан тации печени у взрослых пациентов эндоваскулярные и эндобилиарные методы коррекции этих осложнений стали терапией первой линии, поскольку они менее инвазивны и легче переносятся реципиентами по сравнению с объемными реконструктивными хирургическими вмешательствами.
В последние годы, с развитием малоинвазивных технологий и методов, возросло количество сообщений о новых случаях лечения нарушений кровоснабжения трансплантата и билиодигестивных стриктур. Хотя ургентная ретрансплантация долгое время считалась методом выбора, малоинвазивная интервенционная радиология в настоящее время используется в качестве метода лечения первой линии у взрослых реципиентов в ряде передовых центров.
Тем не менее в педиатрической трансплантации печени эндоваскулярные технологии и методы не так широко изучены. Разработка алгоритмов малоинвазивной интервенционной диагностики и лечения сосудистых осложнений и билиодигестивных стриктур после трансплантации печени для педиатрической практики необходима для достижения оптимальных результатов и сохранения функции трансплантата в долгосрочной перспективе.
Оригинальная статья “Роль эндоваскулярных и эндобилиарных методов в лечении осложнений после трансплантации печени” опубликована в журнале “Вестник трансплантологии и искусственных органов”.
Для цитирования:
Готье С.В., Восканов М.А., Монахов А.Р., Сёмаш К.О. Роль эндоваскулярных и эндобилиарных методов в лечении осложнений после трансплантации печени. Вестник трансплантологии и искусственных органов. 2020;22(4):140-148.
https://doi.org/10.15825/1995-1191-2020-4-140-148
Изображение, используемое для обложки статьи: https://www.swissmedical.net





Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!