Лечение стриктур билиодигестивного анастомоза после трансплантации левого латерального сектора печени
Билиарные осложнения после трансплантации левого латерального сектора (ЛЛС) печени, согласно многим исследованиям, негативно влияют на выживаемость трансплантатов и реципиентов. Таким образом, своевременная коррекция билиарных осложнений, и, в частности, стриктур, позволяет улучшить отдаленные результаты трансплантации.
Лечение стриктур билиодигестивного анастомоза после трансплантации левого латерального сектора печени.
Содержание статьи:
Введение.
Трансплантация фрагментов печени детям берет начало с конца 80-х годов, когда R. Pichlmayer впервые в мире применил методику сплит трансплантации печени, разделив ее по серповидной связке на левый латеральный сектор (ЛЛС) и расширенную правую долю, включавшую I, IV–VIII сегменты печени. Вместе с тем в 1989 году Strong осуществил первую успешную пересадку ЛЛС от прижизненного донора, таким образом став пионером родственной трансплантации наряду с Raia. 90-е годы ознаменовались прорывом в области хирургической гепатологии и трансплантологии. С середины 90-х годов трансплантация фрагментов печени успешно осуществляется во многих странах, в том числе и в России, демонстрируя хорошие результаты и позволяя спасти ранее инкурабельных больных.
Тем не менее серьезной проблемой остаются билиарные осложнения, которые давно зарекомендовали себя как «ахиллесова пята» трансплантации печени. Причем трансплантация фрагментов печени характеризуется более высоким уровнем этих осложнений. Частота билиарных осложнений при трансплантации фрагментов печени детям, по разным данным, варьирует от 4 до 47,4% и в большинстве центров составляет около 15%. Билиарные осложнения обычно классифицируют на желчные свищи, или затеки, анастомотические стриктуры (АС) и неанастомотические стриктуры билиарного анастомоза (НАС). Основными факторами риска развития билиарных осложнений при трансплантации фрагментов печени являются нарушение артериального кровотока, наличие концевого билиобилиарного анастомоза, а также факторы со стороны донора, такие как коагуляционное повреждение протоков на этапе изъятия, наличиенескольких протоков и их малый диаметр.
На сегодняшний день существует ряд мини-инвазивных методик, направленных на коррекцию билиарных стриктур. Эндоскопическое ретроградное стентирование может быть применено у детей, однако в связи с тем, что в детской практике в основном используется билиодигестивный вариант реконструкции, широкое применение этого метода не представляется возможным. Однако существует метод двухбаллонной энтероскопии, который используется в некоторых клиниках, но и у него есть ограничения по применению у детей с весом 15 и менее килограммов.
Перкутанные методы активно применяются у детей со стриктурами билиодигестивного анастомоза в двух основных вариантах: баллонная дилатация и наружное дренирование. При неэффективности указанных методов показана билиарная реконструкция.
НМИЦ ТИО им. ак. В.И. Шумакова обладает наибольшим в России опытом в области трансплантации фрагментов печени детям. Таким образом, анализ собственного опыта и детальное изложение применяемой методики лечения билиарных стриктур при трансплантации ЛЛС печени может иметь научно-практический интерес.
Материалы и методы.
Данное исследование является ретроспективным анализом проспективно заполняемой базы данных, а также медицинских записей в истории болезни, результатов лабораторных анализов и инструментальных исследований. С февраля 2014-го по апрель 2020 года в НМИЦ ТИО им. ак. В.И. Шумакова проведено 425 трансплантаций ЛЛС печени детям: в 399 случаях от родственного донора, в 26 случаях от посмертного донора (сплит-трансплантация). У 19 (4,5%) пациентов диагностированы стриктуры желчных протоков в разные сроки после трансплантации (от 0,2 до 97 мес.). Эти пациенты включены в настоящее исследование. Исследование одобрено этическим комитетом Центра.
Иммуносупрессия.
Иммуносупрессивная терапия псоле трансплантации печени
включала в себя индукционную терапию базиликсимабом, внутривенную инфузию метилпреднизолона на момент реперфузии трансплантата в дозировке 10 мг/кг (с последующей минимизацией или отменой в течение раннего послеоперационного периода) и поддерживающей терапией на основе ингибиторов кальциневрина (такролимус), препараты микофеноловой кислоты и сиролимус использовались опционально, сообразно клинико-лабораторной картине. В случаях трансплантации печени от не совместимого по группе крови родственного донора применялся протокол подготовки, описанный в предыдущих работах и включавший возможность применения плазмаферезов с замещением СЗП AB (IV) и введением ритуксимаба.
Билиарная реконструкция.
Билиарная реконструкция выполнялась после сосудистой реваскуляризации трансплантата на выключенной по Ру петле тощей кишки. Длина петли составляла 40–50 см. В случае предшествующей портоэнтеростомии ранее сформированную петлю сохраняли при следующих условиях: уверенность в жизнеспособности петли (отсутствие обширных десерозаций, множественных перфораций и нарушений кровообращения в петле после проведения энтеролиза), длина петли более 35 см, отсутствие многократно рецидивирующих холангитов в анамнезе. Анастомоз формировали отдельными узловыми швами нитью PDS 6.0 с шагом на протоке 1–1,5 мм.
При наличии двух и более протоков на расстоянии менее 4 мм их объединяли на препаровочном столике или непосредственно перед началом билиарной реконструкции по медиальным стенкам с целью формирования общей орифиции. Если объединение протоков не представлялось возможным, формировали отдельные соустья. Выполнение анастомоза осуществлялось с применением бинокулярных луп с увеличением в 3,5 раза. С целью профилактики желчеистечения применялась оригинальная методика перитонизации стенки билиодигестивного анастомоза круглой связкой трансплантата. С сентября 2017 года каркасное наружное дренирование катете- ром 22–16 Ga (в зависимости от диаметра протоков) по Фелькеру используется рутинно.
Диагностика стриктур.
Динамическое наблюдение пациентов после трансплантации является стандартной практикой трансплантационного центра. В протокол стационарного и амбулаторного обследования детей после пересадки печени входит физикальное обследование и контроль лабораторных параметров, а также УЗИ брюшной полости. В случае если клинико-лабораторная картина холестаза (в том числе зуд, повышение уровня ГГТ, билирубина, гипохолия стула и т. д.) или явления холангита сочетались с расширением желчных протоков более 5 мм, пациенту выполняли МР-холангиографию, на основании чего устанавливали диагноз «стриктура билиодигестивного анастомоза». При этом наличие в анамнезе нарушений артериального кровотока и характерная картина на МР-холангиографии и при УЗИ были основанием для диагноза НАС. Однако если дилатация протоков не сопровождалось какими-либо клиническими и лабораторными изменениями, продолжали динамическое наблюдение и проведение консервативной терапии, в том числе холеретической.
Лечение стриктур билиодигестивного анастомоза.
Описание методики чрескожного чреспеченочного наружно-внутреннего дренирования.
За основу применяемой нами методики чрескожного чреспеченочного наружно-внутреннего дренирования была принята техника, детально изложенная в работе Feier, с некоторыми незначительными допущениями. В нашей практике для чрескожной пункции использовалась игла Chiba 18 Ga. Пункция выполнялась в условиях рентгеноперационной (аппарат Philips Allura Xper FD 20 OR Table, Нидерланды и Shimadzu Bransist alexa, Япония) под ультра звуковой навигацией. Точка пункции, как правило, располагалась в эпигастрии по средней линии. Оптимальным для дренирования считали проток 2 сегмента. После поступления желчи при удалении мандрена вводили небольшое количество водорастворимого контраста (Ультравист 370, Опти рей 350 в разведении со стерильным физраствором 1:4) и таким образом частично контурировали билиарное древо трансплантата. После этого заводили проводник, иглу Chiba меняли на интродьюсер Terumo Radifocus Introducer II 4 Fr, 5 Fr, 6F и с использованием различных катетеров (Merit Medical Performa СB 15F, США, Merit medical Performa KA2 4-5F, США, Terumo Radifocus Optitorque radial TIG II 3,55F, Япония), диагностических проводников: Asahi intecc UniQual Slip-Coat Guidewire 0,035ʹʹ, Biometrix Angio-Line guidewire 0,35ʹʹ, а также коронарных проводников: Asahi intecc Prowaterflex 0.014ʹʹ, Япония; Asahi intecc Fielder 0,014ʹʹ, Япония; Boston Scientific PT2 LS 0.014ʹʹ США, выполняли попытку пройти стриктуру.
В случае успешного прохождения стриктуры с характерными признаками попадания проводника и контрастного вещества в отводящую петлю кишки (формирование проводником «крупных петель», контрастирование циркулярных складок слизистой тонкой кишки) по проводнику устанавливали дренаж Доусона-Мюллера (Cook Medical, США) диаметром 8,5 Fr с дополнительно сформированными 2–3 отверстиями на прямой части дренажа. При невозможности проведения дренажа из-за выраженных стриктур выполняли баллонную дилатацию баллонными катетерами Medtronic Sprinter Legend RX d – 1,25 мм, l – 10–12 мм; d – 1,5 мм, l – 12–15 мм; d – 2,0 мм, l – 15–20 мм, США.
Дистальную петлю устанавливали в кишке с помощью встроенного в дренаж фиксирующего механизма (см. рисунок). В течение 2–3 суток для профилактики реактивного холангита выполнялось наружное желчеотведение по дренажу, затем при отсутствии признаков холангита и улучшающейся лабораторной картине дренаж перекрывали, наблюдали ребенка еще в течение нескольких дней и выписывали.
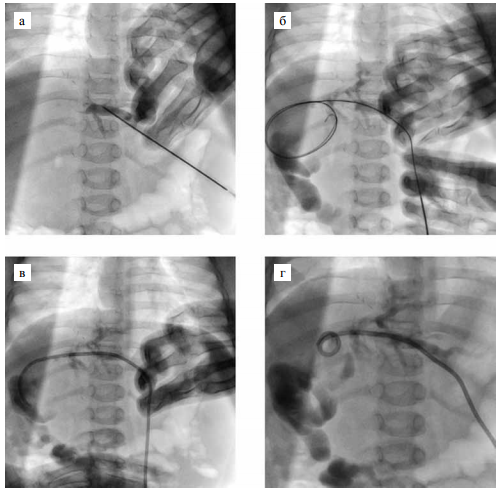
Этапы постановки наружно-внутреннего дренажа: a – контраст введен через иглу Chiba в расширенный проток; б – проводник проведен через стриктуру в отводящую петлю кишки; в – дренаж Доусона-Мюллера по проводнику проведен через стриктуру; г – дистальная петля дренажа установлена в кишке за стриктурой.
В последующем дренаж меняли с ориентировочным промежутком в 3 месяца на большие диаметры (10,2; 12; 14 Fr), по достижении максимального диаметра дренаж удаляли с контролем баллоном для ангиопластики диаметром 5–7 мм (контроль отсутствия «талии» на баллоне).
Если стриктуру пройти не удавалось, оставляли наружную холангиостому для декомпрессии желчных протоков и через 7–10 дней выполняли повторную попытку прохождения стриктуры. Если же стриктура не была пройдена, то индивидуально решалась необходимость третьей попытки или же выполняли билиарную реконструкцию в плановом порядке. В виде блок-схемы этот алгоритм представ- лен на рисунке ниже.
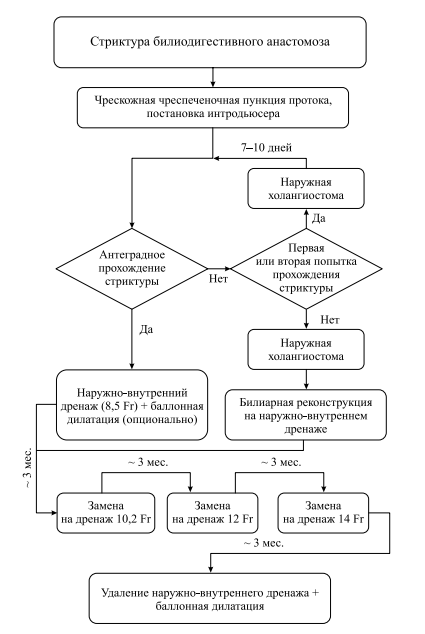
Алгоритм лечения стриктуры билиодигестивного анастомоза после трансплантации ЛЛС печени
Результаты.
Демографические и клинические параметры ре- ципиентов отображены в табл. 1. Наиболее частым заболеванием, приведшим к необходимости транс- плантации у исследуемых пациентов, явилась билиарная атрезия 8 наблюдений (42,1%) и фиброхолангиокистоз или синдром Кароли – 6 случаев (31,6%). В большинстве случаев была проведена родственная трансплантация ЛЛС (84,2%). Билиарные стриктуры чаще развивались более чем через год после транс- плантации (17,8 ± 23,9 мес.) и в большинстве случаев были анастомотическими (n = 17; 89,5%). Из пяти слуачаев, когда антеградно стриктуру пройти не удалось, в четырех была выполнена билиарная реконструкция и в одном успешная ретрансплантация печени от посмертного донора в связи с формированием вторичного билиарного цирроза.
Таблица 1. Основные демографические и клинические характеристики реципиентов ЛЛС со стриктурой билиодигестивного анастомоза.

Примечание. * – на момент трансплантации; PELD – Pediatric End-stage Liver Disease.
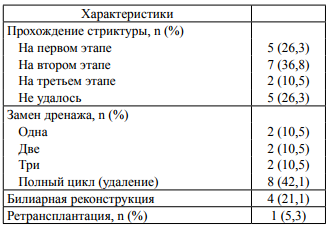
В табл. 2 суммированы некоторые характеристики этапного лечения согласно представленному выше алгоритму. Так, успешное антеградное прохождение стриктуры было в 14 из 19 наблюдений. Причем чаще успешной была вторая попытка прохождения (n = 7; 36,8%), то есть уже после формирования наружной холангиостомы. На момент подачи рукописи у 8 из 14 пациентов (42,1%) наружно-внутренний дренаж был удален, т. е. завершен цикл лечения.
Таблица 2. Особенности лечения пациентов со стриктурами билиодигестивного анастомоза после трансплантации печени.
Результаты лечения у пациентов с антеградным наружно-внутренним стентированием представлены в табл. 3. Период между этапными заменами дренажа ранжировался от 101 до 116 дней. Средний период наблюдения у 8 пациентов с полностью завершенным лечением составил более года (13 ± 8,7 мес.). За этот период лишь у одного из этих пациентов развился холангит, купировавшийся на фоне применения системной антибактериальной терапии, и ни в одном случае не отмечалось рестеноза билиодигестивного анастомоза.
Таблица 3. Результаты лечения у пациентов с чрескожным чреспеченочным антеградным наружно‑внутренним дренированием.

Примечание. * – после удаления наружно-внутреннего дренажа.
Обсуждение.
Согласно многочисленным исследованиям, билиарные осложнения оказывают влияние на выживание как трансплантатов, так и реципиентов. Эндоскопические методы по ряду причин также не всегда являются оптимальными. Открытые реконструкции становятся зачастую обширным хирургическим вмешательством, особенно на отдаленных сроках после трансплантации, ввиду интенсивного спаечного процесса. Наличие в арсенале трансплантолога эффективного малоинвазивного метода коррекции осложнений является необходимым. Этот тезис касается и других аспектов программы трансплантации печени, что делает наличие интервенционной рентгенрадиологии немаловажной частью трансплантационного центра.
Перкутанное наружно-внутреннее (антеградное) дренирование с постановкой стентирующего дренажа получило популярность в лечении различного рода стриктур гепато-панкреато-билиарной зоны. Основные принципы и подходы были транспонированы и на лечение билиарных стриктур после трансплантации фрагментов печени. В представленной работе изложены основные принципы антеградного лечения билиарных стриктур у достаточно узкой категории пациентов – реципиентов ЛЛС печени. Состояние перманентной медикаментозной супрессии, детский возраст, вид трансплантируемого фрагмента и билиодигестивный вариант желчеотведения являются отличительными особенностями этих пациентов.
Применение исключительно баллонной дилатации без длительного формирования соустья на каркасе в виде наружно-внутреннего дренажа характеризуется более высокой частотой рестенозов. В связи с этим представленная методика позволяет разрешить стриктуру с хорошим долгосрочным эффектом. Также следует отметить два случая успешно- го лечения такого грозного и тяжелого осложнения, как НАС, что позволило избежать необходимости ретрансплантации у этих больных. В нашем исследовании антеградное прохождение стриктуры оказалось безуспешным в 5 наблюдениях, из которых в четырех случаях (21,1%) потребовалось выполнение билиарной реконструкции и в одном случае (5,3%) потребовалось проведение ретрансплантации. Следует отметить, что наличие холангиостомы перед операцией не только позволяло стабилизировать больного, разрешив желтуху и/или холангит, но и являлось удобным ориентиром для навигации в условиях выраженного спаечного процесса. А также позволяло комфортно сформировать анастомоз на наружно-внутреннем дренаже.
Данная работа лимитирована относительно не- большим числом наблюдений, что связано с относительной невысокой частотой этого осложнения (4,5%). Несмотря на то что исследование является одноцентровым и нерандомизированным, успешный многолетний опыт клиники может быть полезен для других клиник, занимающихся трансплантацией фрагментов печени.
Выводы.
- Своевременная диагностика и лечение стриктур билиодигестивного анастомоза после трансплантации фрагментов печени позволяет избежать утраты трансплантата.
- Использование малоинвазивных подходов с применением методов интервенционной радиологии позволяет эффективно устранить билиарные стриктуры у большинства детей после трансплантации левого латерального сектора печени.
- Предложенная мето дика является эффективной и безопасной.
Оригинальная статья «Лечение стриктур билиодигестивного анастомоза после трансплантации левого латерального сектора печени» опубликована в журнале «Вестник трансплантологии и искусственных органов».
Для цитирования:
Монахов А.Р., Миронков Б.Л., Восканов М.А., Мещеряков С.В., Азоев Э.Т., Семаш К.О., Джанбеков Т.А., Силина О.В., Готье С.В. Лечение стриктур билиодигестивного анастомоза после трансплантации левого латерального сектора печени. Вестник трансплантологии и искусственных органов. 2020;22(3):18-25.





Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!