Обследование, подготовка и ведение доноров печени
Отбор, подготовка и периоперационное ведение прижизненных родственных доноров печени – сложный и ответственный вид медицинской помощи, требующий от врачей максимального вовлечения на всех этапах. В данной статье подробно описана селекция и подготовка донора к резекции печени, основные принципы донорской резекционной хирургии. Также подробно описано послеоперационное ведение доноров и их реабилитация.
Введение.
Содержание статьи:
Родственная трансплантация печени на сегодняшний день является высокоэффективным метод лечения пациентов с терминальными стадиями поражения печени. В Республике Узбекистан программа по родственной трансплантации печени стартовала в 2018 году, когда в тесном сотрудничестве с российскими коллегами, в Республиканском специализированном научно-практическом медицинском центре хирургии имени академика В. Вахидова академиком С. В. Готье, была выполнена первая в Республике родственная трансплантация печени. На регулярной основе трансплантации печени начали проводится только с 2022 года. На сегодняшний момент в стенах центра выполнено более 50 родственных трансплантаций печени.
Прижизненное донорство фрагментов печени является вариантом получения трансплантата печени для пациента, нуждающегося в пересадке. Преимуществами трансплантации фрагмента печени от прижизненного родственного донора является независимость от системы обеспечения трупными органами, и, соответственно, возможность планирования операции в оптимальные сроки. Даже при фульминантных повреждениях печени, требующих, как правило, срочной пересадки печени, живой родственный донор является доступным источником получения трансплантата, при условии его наличия и адекватном быстром обследовании и подготовке к операции.
Основным преимуществом трансплантата от живого донора является прогнозируемое отбором и подготовкой родственных доноров качество печеночной паренхимы, а также плановым характером оперативного вмешательства. Современный уровень печеночной хирургии и методов консервации органов позволяет получить от живого донора высококачественный трансплантат с минимальными ишемическими и механическими повреждениями [1].
Использование фрагмента печени от ближайшего родственника позволяет рассчитывать на его более благоприятную иммунологическую адаптацию в организме реципиента за счет сходных HLA характеристик гаплотипов [2,3].
Потенциальные риски родственного донорства.
Все основные недостатки родственной трансплантации печени связаны с потенциальным риском для здоровья и жизни донора, неизбежность которого вызывает определенные скептические отзывы и этические вопросы. Действительно, инвазивные методы обследования (биопсия печени, ангиография, использование внутривенного контрастирования при спиральной компьютерной томографии и т.д.), анестезиологическое пособие, хирургическое вмешательство и послеоперационное ведение на определенных этапах могут создать предпосылки для осложнений у живого донора. Как и при общехирургической резекции печени операция у донора влечет за собой риски повреждения внутренних органов и крупных сосудов, развития кровотечения, возникновения внутрибрюшной инфекции и т.д.
Так, по данным мировой литературы, частота донорских осложнений может достигать 9-39% [42,2].
Наиболее часто встречающиеся осложнения относятся к I-II стадии по классификации Clavien—Dindo (Таблица 1) [36, 42]. К таким осложнениям относятся инфекционные раневые осложнения, послеоперационные грыжи, возникающие в отдаленном периоде после операции, а также желчеистечения [42,2].
Классификация хирургических осложнений Clavien—Dindo
| Степень | Определение |
| I | Любые отклонения от нормального послеоперационного течения, не требующие медикаментозного лечения или хирургического, эндоскопического, радиологического вмешательства. Разрешается терапевтическое лечение: антипиретики, анальгетики, диуретики, электролиты, физиотерапия. Сюда же относится лечение раневой инфекции. |
| II | Требуется лечение в виде гемотрансфузии, энтерального или парентерального питания. |
| III | Требуется хирургическое, эндоскопическое или радиологическое вмешательство: |
| IIIa | Вмешательство без общего обезболивания. |
| IIIb | Вмешательство под общим обезболиванием. |
| IV | Жизнеугрожающие осложнения (включая осложнения со стороны ЦНС) *, требующие интенсивной терапии, наблюдения в отделении реанимации, резекции органа: |
| IVa | Недостаточность одного органа. |
| IVb | Полиорганная недостаточность. |
| V | Смерть больного. |
* Геморрагический инсульт, ишемический инсульт, субарахноидальное кровотечение, за исключением транзиторной ишемической атаки [36].
Факторами развития осложнений являются опыт трансплантационной программы, тип изымаемого трансплантата, селекция потенциальных доноров, анатомические аномалии печени, избыточная масса тела донора (ИМТ > 30) [42].
Предикторами развития осложнений у доноров являются интраоперационная гипотензия (систолическое давление менее 100 мм. рт. ст.), интраоперационная трансфузия > 4 доз эр.массы, время операции (при открытом изъятии) > 400 мин.
Тем не менее, имеются сообщения, что современный уровень анестезиологии и хирургической гепатологии позволил снизить степень донорского риска до разряда простой лапаротомии. К настоящему времени в мире частота донорской летальности, что составляет около 0,2-4%. Среди причин смерти доноров описаны кардиореспираторные нарушения, сепсис, суицид [43]. В Республике Узбекистан зарегистрирован 1 случай смерти родственного донора фрагмента печени.
Несмотря на ничтожную частоту летальности среди родственных доноров части печени, которая не превышает таковую для родственных доноров почки и вряд ли может опорочить саму идею родственной трансплантации печени, планирование операций у родственных доноров предусматривает максимальную ответственность врачей как при обследовании донора, так и при выполнении операции [2,6,23,37,2].
Классификация по фрагменту донации
Родственных доноров фрагментов печени можно разделить на классификацию по фрагменту донации:
- донор левого латерального сектора печени;
- донор правого заднего сектора печени;
- донор левой доли печени;
- донор правой доли печени;
- донор моносегмента S2 печени;
- донор моносегмента S3 печени.
Эта классификация основана на фрагменте донации, то есть том фрагменте, который врач трансплантолог планирует взять у донора для последующей трансплантации реципиенту. Фрагмент донации определяется потребностью реципиента на основании его антропометрических параметров. Наиболее распространенным в клинической практике методом оценки соответствия массы предполагаемого трансплантата, является отношение массы предполагаемого трансплантата к массе тела реципиента – Graft to Recipient Weight Ratio(GRWR). На его основании определяется необходимый по объёму фрагмент донации. Об этом подробно описано в главе «Селекция потенциального донора фрагмента печени».
Селекция родственных доноров печени.
Врач, оценивающий пригодность потенциального родственного донора, должен провести ряд обследований для селекции и подтверждения возможности изъятия фрагмента печени у конкретного пациента для последующей трансплантации.
Первичная оценка потенциального донора
- Кровное родство (Закон от 11 мая 2022 года № ЗРУ–768 «О трансплантации органов и тканей человека».);
- возраст старше 18 лет – 50 лет;
- добровольное информированное волеизъявление с видео-фиксацией;
- группоспецифическая принадлежность по системе AB0;
- подробное выяснение анамнеза (в том числе, перенесенных заболеваний; аллергоанамнеза, наличия предшествующих травм и операций);
- индекс массы тела от 18,5 до 30;
- психосоциальная оценка.
Комментарий: несовместимость по системе АВ0 не всегда является противопоказанием для донорства фрагмента печени [41]!
Цель первичной оценки – исключение претендентов с заболеваниями печени, перенесенными обширными хирургическими вмешательствами на органах брюшной полости, наличием тяжелых черепно-мозговых травм в анамнезе, а также с инфекционными и хроническими заболеваниями. Доноры с неудовлетворительной психосоциальной оценкой также не подлежат дальнейшему обследованию.
Обследование потенциального донора
Обследование на этапе отбора потенциального родственного донора
Комплексная и исчерпывающая оценка потенциального родственного донора позволяет минимизировать риски послеоперационных осложнений, обеспечить его безопасность и скорейшую реабилитацию, что является важнейшим принципом, лежащим в основе прижизненного донорства органов.
Кроме того, правильный выбор и оценка потенциального родственного донора позволяет получить трансплантат высокого качества, как с функциональной, так и с анатомической точки зрения, что в конечном итоге, имеет решающее значение для успеха операции [7].
Комплексная медицинская оценка потенциального донора
Основной задача этапа – объективная оценка здоровья донора, исключение абсолютных и относительных противопоказаний к донорству фрагмента печени. Потенциальным донорам с избыточным весом (ИМТ >25) даются общие рекомендации по питанию и физическим нагрузкам с целью снижения веса и повторного обследования [4,8,9].
Категорически не рекомендуется рассматривать в качестве потенциальных родственных доноров людей с любыми диффузными заболеваниями печени, а также хроническими и инфекционными заболеваниями [1,6,10]. Относительными противопоказаниями к донорству являются состояния, которые после проведения соответствующего медикаментозного лечения могут быть полностью устранены.
Алгоритмы действий врача
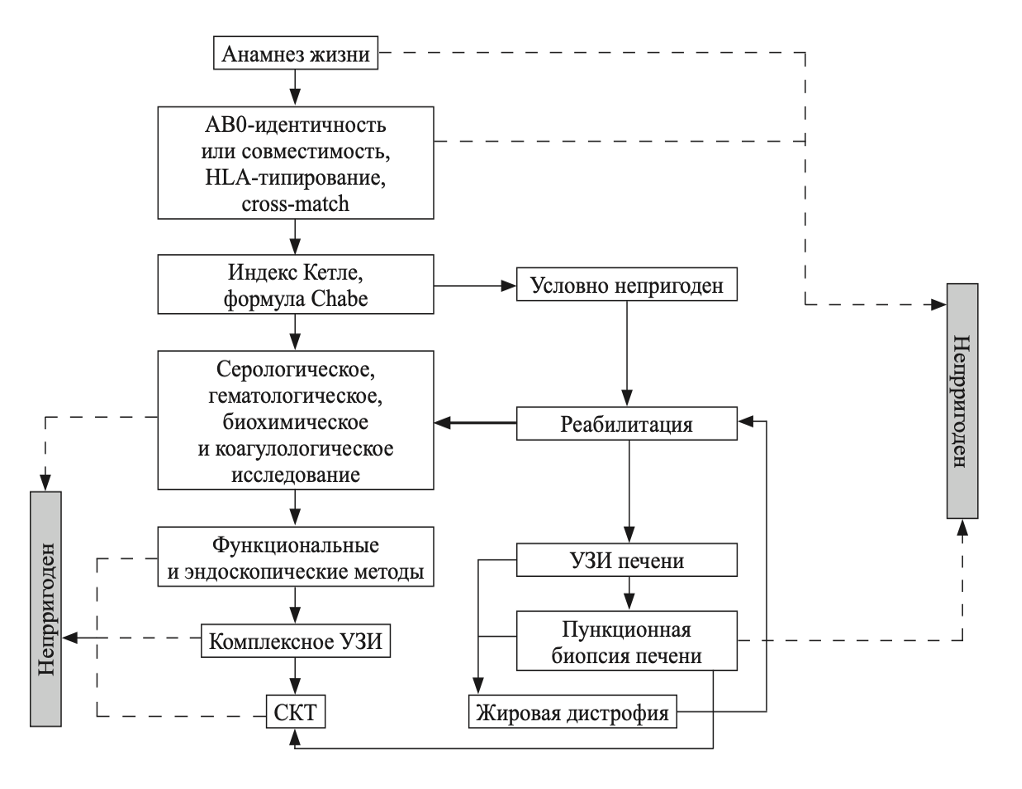
Лабораторные диагностические исследования
- Рекомендуется определение антител к вирусу гепатита A (Hepatitis A virus) в крови, определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита D (Hepatitis D virus) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови, определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови, определение антител к бледной трепонеме (Treponema pallidum) в нетрепонемных тестах (RPR, РМП) (качественное и полуколичественное исследование) в сыворотке крови, определение антигена вируса гепатита C (Hepatitis C virus) в крови [1,6,10];
- Рекомендуется определение основных групп по системе AB0, определение антигена Dсистемы Резус (резус-фактор) группы крови [1,6,10];
- Рекомендуется выполнить общий анализ крови (с лейкоцитарной формулой) [1,6,10];
- Рекомендуется исследование уровня натрия в крови, исследование уровня калия в крови, исследование уровня хлоридов в крови, Анализ крови биохимический общетерапевтический, исследование кислотно-основного состояния и газов крови [1,6,10];
- Рекомендуется выполнение развернутой коагулограммы [1,6,10];
- Рекомендуется выполнение HLA-типирования (определение антигенов (генов) главного комплекса гистосовместимости I и II классов; проводится как реципиентам, так и потенциальным родственным донорам) и перекрестная лимфоцитотоксическая проба с кровью потенциальных родственных доноров. Если HLA-типирование имеет прикладное значение и может влиять, в основном, на особенности проведения иммуносупрессивной терапии у реципиента, то положительная лифоцитотоксическая проба оказывает влияние на частоту развития отторжения [1,6,10];
- Рекомендуется определение антител классов M, G (IgM, IgG) к цитомегаловирусу (Cytomegalovirus) в крови, Определение антител классов M, G (IgM, IgG) к вирусу Эпштейна-Барра (Epstein — Barr virus) в крови, Определение антител к вирусу простого герпеса (Herpessimplex virus) в крови [1,6,10].
Инструментальные диагностические исследования
- Обзорная рентгенография органов грудной клетки [1,6,10];
- Электрокардиография) [1,6,10];
- Эхокардиография [1,6,10];
- Эзофагогастродуоденоскопия [1,6,10];
- Исследование функции внешнего дыхания (по показаниям [1,6,10];
- Ультразвуковая допплерография вен нижних конечностей [1,6,10].
В случае, если донор проживает далеко от трансплантологического центра, допускается прохождение вышеперечисленных диагностических процедур в клиниках по месту жительства [38]. Естественно, если при обследовании у потенциального донора выявляются те или иные отклонения от референсных значений, рекомедуется провести дополнительный комплекс диагностических мер по показаниям [9,10].
При выявлении относительных противопоказаний к донорству фрагментов печени, таких как кариес, язвенная болезнь желудка и избыточная масса тела, рекомендуется необходимую терапию с целью коррекции данного состояния. Таких потенциальных доноров рекомендуется продолжать обследовать по программе донорства фрагментов печени, однако, могут быть допущены до оперативного вмешательства лишь в случае отсутствия противопоказаний при контрольных исследованиях [10].
Обследование потенциальных родственных доноров
| Обязательные исследования | Дополнительные исследования | ||
| Лабораторные методы | Инструментальные методы + специалисты | Лабораторные методы | Инструментальные методы + специалисты |
| ●Клинический анализ крови с лейкоцитарной формулой ●Развернутый биохимический анализ крови●Коагулограмма ● Исследование крови на маркеры вирусов гепатита, ВИЧ, сифилис ● Общий анализ мочи ● HLA-типирование и перекрестная лимфоцитотоксическая проба с реципиентом |
● Ультразвуковое исследование брюшной полости ● Рентгенография грудной клетки● ЭГДС ● ЭКГ ●Эхо КГ ● Компьютерная томография органов брюшной полости с внутривенным контрастированием, МРТ-холангиография ■ Специалисты: ● врач-стоматолог, врач-акушер-гинеколог, |
■ Определение уровня органических и аминокислот ■Генетическое обследование на предмет: ●Дефицита альфа-1- антитрипсина● Тромбофилии | ● Компьютерная томография головного мозга (по показаниям) ● МСКТ сердца ● Холтеровское мониторирование ЧСС● Суточное мониторирование АД ● Нагрузочные пробы (велоэргометрия, тредмил-тест) ■ Специалисты: ● Кардиолог ● врач-уролог, врач-офтальмолог, генетик (по показаниям) |
Оценка печени потенциального донора
Параллельным процессом обследования потенциального донора является достоверное определение морфофункциональных и анатомических характеристик печени с точки зрения использования её в качестве трансплантата [2].
Рекомендуется использовать основные методы исследований на этом этапе – УЗИ печени, мультиспиральная компьютерная томография органов брюшной полости с внутривенным контрастированием, магнитно-резонанасная холангиография, а также пункционная биопсия печени [1,6,10].
При оценке печени потенциального родственного донора рекомендуется выполнить следующие исследования:
- Ультразвуковая диагностика с целью качественной оценки паренхимы, которая включает: однородность, эхогенность паренхимы и переднезадний размер печени, при выявлении любых признаков жирового гепатоза показана пункционная биопсия печени [1,6,10].
- Допплерфлуометрия печеночного кровотока: визуализация основных ветвей печеночной артерии, воротной и печеночных [1,6,10].
- Рентгеновская спиральная компьютерная томография, выполненная методикой объемного сканирования с контрастированием, что позволяет изучить структуру паренхимы печени; получить объемное изображение ангиоархитектоники печени и всех источников артериального и портального кровоснабжения; детально определить строение венозного оттока печени; выполнить виртуальную резекцию печени и оценить размеры, а также объем удаляемой и остающейся части органа [1,6,10].
ВАЖНО! На этапе прохождение МСКТ – крайне важно провести консультацию с оперирующим хирургом для исключения анатомических противопоказаний к донорству!
- МР-холангиография является альтернативным неинвазивным методом традиционной интраоперационной холангиографии. Позволяет на дооперационном этапе определить вариантную анатомию желчеотведения [1,6,10].
- Фиброэластометрия печени рекомендуется в качестве эффективного инструмента скрининга для определения стеатоза паренхимы печени у потенциальных доноров без применения биопсии [14].
- Биопсия печени под контролем ультразвукового исследования: показаниями являются избыточная масса тела (индекс массы тела > 25); повышение эхогенности паренхимы печени при УЗИ, наличие в анамнезе периодического или систематического приема алкоголя, наличие в анамнезе у женщин периодического или систематического приема пероральных контрацептивов. При выполнении биопсии, выверенное с помощью УЗИ направление движения иглы позволяет избежать ранения крупных печеночных сосудов и плеврального синуса. Динамический контроль гемостаза рекомендуется осуществлять при помощи УЗИ-мониторинга в течение нескольких часов [5,6,11].
Биопсия печени является инвазивным методом. В настоящее время существуют исследования, доказывающие эффективность применения альтернативных методик оценки функционального качества печени, такие как МРТ, УЗИ, МСКТ и фиброэластометрия, которые могут стать потенциальной альтернативой биопсии печени [14].
На сегодняшний день широко известен морфологический метод оценки жировой дистрофии печени, основанный на подсчете количества пораженных гепатоцитов [8,12,40]: Iстепень (легкая) — жировые вакуоли выявляются в 1/3 гепатоцитов; II степень (умеренная) — жировые вакуоли определяются в более, чем в 1/3 гепатоцитов; III степень жировой дистрофии (выраженная) — жировые вакуоли определяются в 2/3 гепатоцитов.
Наличие у донора выраженной макровезикулярной формы стеатоза печени (> 60%) ассоциируется с высоким риском (50-60%) развития первичной дисфункции трансплантата, вплоть до первичного нефункционирования. В настоящее время в мире нет общепринятого допустимого уровня стеатоза печени для донора.
При стабильном состоянии реципиента, легком или умеренном стеатозе печени по данным УЗИ и/или пункционной биопсии печени, рекомендуется кондиционирование донора в течение месяца или более и повторная оценка качества паренхимы с помощью УЗИ и морфологического исследования биоптата печени [10].
Градация стеатоза печени
| Стадия жирового гепатоза | Процент повреждённых гепатоцитов |
| S0 – нет стеатоза или легкий стеатоз | 0-10% |
| S1 – умеренный стеатоз | 11-33% |
| S2 – выраженный стеатоз | 34-66% |
| S3 – тяжелый стеатоз | >66% |
Классификация гепатостеатоза на основании биопсии печени и фиброэластометрии печени [8, 40].
Иные диагностические исследования
При условии удовлетворительных результатов клинико-лабораторного обследования, у родственных доноров оценивается структурно-функциональное состояние сердечно-сосудистой, дыхательной и пищеварительной систем с помощью рентгенологических, спирометрических, ультразвуковых и эндоскопических методов. Кроме того, к этому этапу обследования рекомендуется в обязательном порядке привлекать врачей следующих специальностей:
- стоматология;
- гинекология;
по показаниям: урология, офтальмология, оториноларингология, неврология и т.д.
Особенности отбора доноров для реципиентов с малой массой тела
Согласно анализу базы данных UNOS (США), масса ребенка на момент трансплантации менее 5 кг является фактором риска и сопровождается большей частотой потери трансплантата и более высокой смертностью. Безусловно, причины, приводящие к ухудшению результатов в этой группе пациентов, носят мультифакторный характер, однако, синдрому избыточного по размерам трансплантата некоторые авторы отводят ведущую роль.
Наиболее распространенным в клинической практике методом оценки соответствия массы предполагаемого трансплантата, является отношение массы предполагаемого трансплантата к массе тела реципиента.
Целью преодоления несоответствия между размерами трансплантата и брюшной полостью ребенка, используются два принципиальных подхода: редукция трансплантата (неанатомическая резекция трансплантата ЛЛС) и моносегментарная трансплантация (трансплантация сегмента IIили III). Современные авторы сходятся во мнении, что наиболее важным размером трансплантата, помимо коэффициента помимо GRWR, является его толщина [6, 15, 38].
Соответствие по размеру трансплантата печени
| Отношение объема трансплантата к стандартному объему печени | Отношение массы трансплантата к массе тела реципиента
(graft to weight ratio) |
|
| Недостаточный по размеру трансплантат
(«small-for-size graft») |
≤0.5 | <1% |
| Достаточный по размеру трансплантат
(«size-matched graft») |
>0.5, но ≤1.5 | ≥1%, но <3% |
| Избыточный по размеру трансплантат
(«large-for-size graft») |
>1.5, но ≤2 | ≥3%, но <4% |
| Сверхизбыточный по размеру трансплантат
(«extra large-for-size») |
>2 | ≥4% |
Наиболее распространенным в клинической практике методом оценки соответствия массы предполагаемого трансплантата, является отношение массы предполагаемого трансплантата к массе тела реципиента – graft to recipient weight ratio (GRWR), представленном в таблице №4. Так, оптимальным показателем GRWR будет являться соотношение коэффициента от 1 до 3% [15].
Стационарный этап ведения родственных доноров фрагмента печени.
Предоперационный период.
Показания для экстренной госпитализации в медицинскую организацию:
- необходимость проведения ургентной трансплантации печени реципиенту от родственного донора;
- развитие тяжелых послеоперационных осложнений у донора фрагмента печени;
- развитие серьезных осложнений при выполнении инвазивных манипуляций во время амбулаторного обследования донора (при выполнении пункционной биопсии печени, эзофагогастродуоденоскопии и т.д.).
Показания для плановой госпитализации в медицинскую организацию:
- проведение плановой трансплантации печени реципиенту от родственного донора;
- коррекция послеоперационных осложнений в плановом порядке (например, для проведения пластики послеоперационной вентральной грыжи и т.п.)
Родственный донор госпитализируется за несколько дней до предполагаемого оперативного вмешательства. Рекомендуется размещать предоперационную пару «донор-реципиент» в отдельную палату с отдельным санитарным узлом. При наличии показаний проводится предоперационное дообследование: анализы крови, консультации профильных специалистов, осмотр оперирующего хирурга и анестезиолога.
Периоперационный мониторинг
Выполнение хирургического вмешательства родственным донорам фрагментов печени рекомендуется выполнять в условиях современной комбинированной общей анестезии с постоянным мониторингом показателей функционального состояния всех жизненно-важных органов и систем [6]:
- инвазивный мониторинг артериального и центрального венозного давления;
- электрокардиография;
- пульсоксиметрия;
- баланс центральной (в прямой кишке и\или пищеводе) и периферической температуры;
- анализ водно-электролитного и газового состава крови;
- контроль концентрации изофлюрана во вдыхаемой смеси.
Рекомендуется поддержание низкого ЦВД (ниже 5 cmH2O) с тщательным контролем во время операции на печени. Также рекомендуется вводить оптимальное кол-во растворов коллоидов и кристаллоидов для поддержания внутрисосудистого объема и избегать гиперхлоремического ацидоза или почечной недостаточности [52].
Хирургическая техника
Резекцию печени с целью использования ее фрагмента в качестве трансплантата необходимо выполнять в условиях сохраненного кровообращения [3,5].
Основными типами хирургического вмешательства у родственных доноров фрагмента печени являются левосторонняя латеральная секторэктомия печени, гемигепатэктомия справа, гемигепатэктомия слева. В отдельных случаях может быть выполнена резекция правой задней секции. В случаях трансплантации печени детям с массой тела менее 6 кг может быть рассмотрен вариант моносегментарной трансплантации (сегмент II или III). Выбор удаляемого фрагмента печени зависит от антропометрических характеристик реципиента, соотнесенных с данными МСКТ-волюметрии донора [51].
Также в мировой практике описаны способы трансплантации и других фрагментов печени живого донора, в том числе трансплантации двух левых латеральных секторов от разных живых доноров и др., однако эти методы ограничиваются опытом нескольких клиник и не могут быть рекомендованы для широкой практики [45].
За последние два десятилетия в мировую клиническую практику широко внедряются малоинвазивные подходы: гибридный, мануально-ассистированная техника, полностью лапароскопическое изъятие фрагментов печени и робот-ассистированные методы [54]. Робот-ассистированные и лапароскопические техники могут быть рекомендованы для изъятия левосторонних фрагментов печени, при наличии должного опыта хирургической команды в то время, как донорство правой доли печени с использованием миниинвазивных методов (лапароскопический, роботический) на данный момент находятся в состоянии валидации и требуют накопления опыта [16-22, 35, 44,51,53]
При долевых лапароскопических резекциях рекомендовано применение внутривенного индоцианина зеленого для проведения интраоперационной ICG-холангиографии при наличии соответствующего оборудования [46,51].
Основные цели операции [24]:
- безопасность жизни и здоровья родственного донора;
- получение жизнеспособного, достаточного по массе фрагмента печени, обладающего автономной ангиоархитектоникой и системой желчеоттока [6].
Основные задачи хирургической бригады:
- минимизация оперативной травмы;
- минимизация кровопотери;
- уменьшение времени тепловой ишемии при изъятии трансплантата.
Выбор формы кожного разреза — на усмотрение хирурга. Это зависит от размера живота, расположения и размеров печени, характера предполагаемого вмешательства. Разрез по “Calne” должен быть исключен ввиду высокого риска п/о вентральных грыж [52].
Вайт-тест
По данным отдельных исследований, при открытом изъятии долевого трансплантата рекомендуется применение т.н. вайт-теста, что может снизить частоту послеоперационных осложнений. Однако данная рекомендация имеет небольшую силу и требует дальнейших исследований [47].
Венопластика
После изъятия трансплантата на препаровочном столике может быть выполнена венопластика: объединение устьев вен с целью получения общего устья, восстановление оттока по венам V/VIII сегментов (при условии их значимости) и т.п. Таким образом, рекомендуется обеспечить адекватный венозный отток для адекватного функционирования трансплантата [48].
Послеоперационный период у родственных доноров фрагмента печени.
Первые часы послеоперационного периода донору рекомендовано находиться в палате интенсивной терапии и реанимации с осуществлением комплексного мониторинга жизненно важных систем: ЭКГ, частоты сердечных сокращений, артериального давления, частоты дыхательных движений, периферической температуры тела, центрального венозного давления, пульсоксиметрии, темпа диуреза [1,10,11].
В период пребывания в палате интенсивной терапии и реанимации у родственного донора сохраняется центральный венозный катетер, эластичные бинты (компрессионное бельё) на нижних конечностях, назогастральный зонд и мочевой катетер, обязательное применение которых входит в протокол анестезиологического обеспечения.
С учетом объема и характера хирургического вмешательства, а также проведенного анестезиологического пособия всем донорам рекомендуется комбинированная инфузионная, трансфузионная и лекарственная терапия [2].
Инфузионную терапию рекомендуется проводится в условиях контроля центрального венозного давления и строгого учета баланса между введенной и выделенной жидкостью. Она включала в себя адекватную гидратацию донора в условиях полного голода из расчета 50-60 мл/кг, энергетическое восполнение за счет углеводов и коррекцию электролитных нарушений. С этой целью используются растворы глюкозы, калия хлорида, Рингера, КМА (аспаргинат калия и магния), NaCl — 0,9% и т.д., дозы и режим введения которых варьируют в зависимости от индивидуальных особенностей организма донора и показателей кислотно-щелочного состояния крови. Данный вид лабораторного контроля проводился по мере необходимости, в среднем 1 раз в 3-4 часа [1,10,11].
Трансфузионная терапия в основном заключается в назначении растворов альбумина человеческого. Объем трансфузионной терапии пропорционален тяжести оперативного вмешательства и объёму кровопотери. Необходимость трансфузии таких компонентов крови как СЗП, эр.массы, криопреципитата и др. рекомендуется определять индивидуально[51,52].
Лекарственная терапия у родственных доноров:
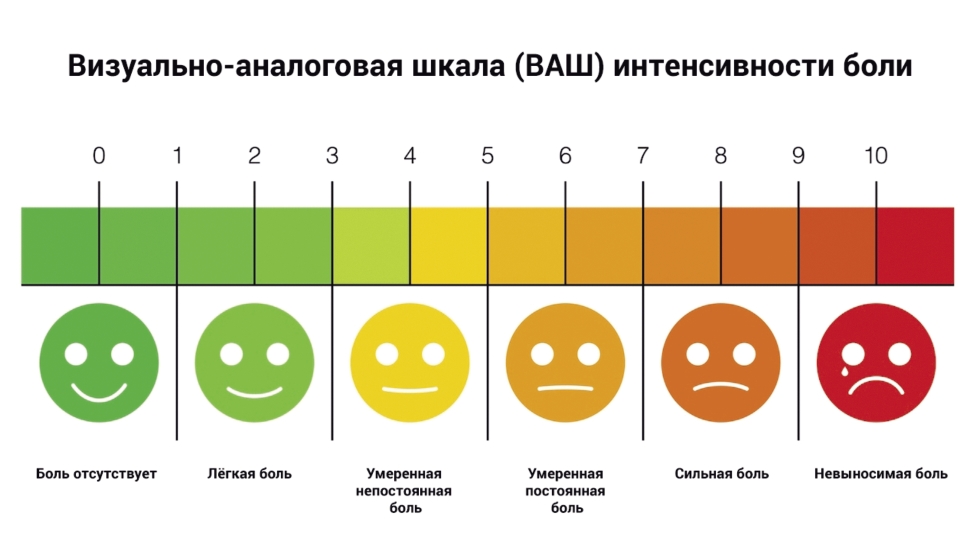
- Рекомендуется адекватное обезболивание на основании субъективных болевых ощущений по визуальной аналоговой шкале (рисунок 1) [4,5,6,35,40];
- Рекомендуется проведение антибактериальной терапии с момента операции [6]. Критерии эффективности: клиническая картина, температура тела, количество лейкоцитов в крови и лейкоцитарная формула, СОЭ, уровень фибриногена в крови;
- Рекомендуется спазмолитическая терапия (предпочтительно использование мебеверина, как более селективного, и в меньшей степени влияющего на моторику желудочно-кишечного тракта препарата) [6];
- Рекомендовано назначение противорвотных средств (может быть использовано 1 или два препарата) [6];
- Рекомендовано проведение гастропротективной терапии [6];
- Антикоагулянтную терапию (низкомолекулярный гепарин), рекомендуется назначать в профилактической дозировке с конца первых 24 часов при отсутствии данных за кровотечение [6].
Визуальная аналоговая шкала интенсивности боли
В течение первых дней после операции состояние донора рекомендовано оценивать путем комплексного обследования, включающего:
- Общий осмотр с физикальным обследованием (минимум раз в сутки);
- Термометрия (несколько раз в сутки);
- Измерение артериального давления и частоты сердечных сокращений;
- Лабораторные методы обследования (общий анализ крови с лейкоформулой, развернутый биохимический анализ крови, коагулограмма);
- Комплексное УЗИ 1 раз в сутки (оцениваются размеры, эхогенность культи печени, желчные протоки, кровотоки при помощи дуплексного сканирования, наличие скоплений жидкости в брюшной, плевральной полостях) [1,6,10].
Кроме того, рекомендована ранняя постепенная активизация (с первых послеоперационных суток), и дыхательная гимнастика, поскольку это ускоряет реабилитацию родственных доноров. Также пациентам показана общая врачебная диета со вторых послеоперационных суток (при отсутствии гастростаза) [6]. В течение трёх-шести месяцев после операции рекомендуется ношение бандажа и ограничение физических нагрузок. С целью профилактики отдаленных осложнений через 1-1,5 месяца после операции донору следует в амбулаторном порядке провести контрольное ультразвуковое исследование, а также лабораторный контроль (общий анализ крови с лейкоформулой, биохимический анализ крови, коагулограмма) [6].
Основные факторы риска развития осложнений у родственных доноров фрагментов печени
Как и любое хирургическое вмешательство, донорская резекция печени может иметь определенные риски. По данным крупных международных исследований, определены следующие факторы риска:
- Донорство правой доли печени [1,10,11];
- Использование в качестве доноров кандидатов со степенью стеатоза более 10% [1,10,11,33,34];
- Использование в качестве доноров кандидатов со сложной сосудистой и/или билиарной анатомией [34]
Оценка послеоперационных осложнений
Частота развития осложнений у доноров фрагментов печени колеблется в широких пределах в различных трансплантационных центрах (от 0 до 67%), что связано как с неодинаковыми подходами к селекции доноров, так и с отсутствием единой простой и информативной классификации и градации осложнений для доноров печени. В последнее время, с целью систематизации осложнений у прижизненных доноров части печени, стала активно применяться модификация классификации P.A. Clavien (может быть использована классификация в модификации Barr и Belghiti 2006 года или в модификации Dindo 2004 года [36]). Несмотря на то, что результаты американских, азиатских и европейских исследований различаются, частота развития серьезных осложнений (класс III — IV по Сlavien) у доноров правой доли печени выше, чем у доноров левой доли или левого латерального сектора печени [1]. Частота между донорскими осложнениями при лапароскопическом изъятии и традиционном достоверно не различается [51,55]. Однако, реабилитация доноров при лапароскопическом изъятии протекает быстрее, также достоверно доказано, что субъективно болевой синдром при лапароскопическом изъятии ниже в сравнении с открытым изъятием [16,51, 55].
Трансплантация печени живого донора связана с хорошо документированным риском заболеваемости и смертности доноров. Ни одно учреждение, занимающееся этой клинической деятельностью высокого риска, не застраховано от этого риска. Исследования в области антикризисного управления показывают, что подготовка к катастрофическому событию является обязательной как для надлежащего реагирования, так и для предотвращения этих случаев [3,37].
Показания к выписке из медицинской организации:
- отсутствие послеоперационных осложнений у донора фрагмента печени;
- восстановление лабораторных показателей (тенденция к их нормализации);
- отсутствие выраженного болевого синдрома;
- отсутствие выраженных диспепсических явлений.
Амбулаторное ведение родственных доноров фрагмента печени после оперативного вмешательства.
Учитывая, что прижизненный донор печени является здоровым трудоспособным членом общества, особую роль играет предотвращение нежелательных последствий после операции на печени. В связи с этим, в течение года после операции донору рекомендуется воздерживаться от жирной, жареной, острой и соленой пищи, а также приема алкогольсодержащих напитков. Ограничение физических нагрузок следует соблюдать в период до 1-6 месяцев [6].
Контрольное амбулаторное обследование следует пройти в трансплантационном центре или в поликлинике по месту жительства через 1-3 месяца после операции. При этом необходимость пожизненного регулярного наблюдения отсутствует. Однако, в случае возникновения каких-либо жалоб в отдаленном послеоперационном периоде (боли, лихорадка и др.) следует провести внеплановое комплексное обследование с целью выявления причины ухудшения состояния [6].
Заключение.
Донорская хирургия печени — наиболее ответственная из всех оперативных пособий на печени, поскольку на кону стоит жизнь и здоровье родственного донора – абсолютно здорового человека, который решил пожертвовать частью себя ради спасения жизни своего родственника. Оперирующий хирург должен непременно понимать свою ответственность и крайне важно с должным пониманием должен подойти к вопросу селекции родственного донора и к его периоперационному ведению, поскольку от этого напрямую будет завесить прогноз и качество жизни этой когорты пациентов. Задача всех врачей на всех этапах селекции, подготовки, оперативного вмешательства, а также на этапе реабилитации – снизить риск послеоперационных осложнений у донора и обеспечить скорейшую реабилитацию родственных доноров после перенесённой операции.




Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!