Измерение оксигенации как система оценки функции трансплантата печени в раннем послеоперационном периоде
В данной статье описаны результаты применения региональной инфракрасной спектрометрии (NIRS) у пациентов после трансплантации печени для оценки функции трансплантата в раннем послеоперационном периоде.
Введение.
Содержание статьи:
Оценка динамики региональной оксигенации (SrO2), которую можно отследить при помощи NIRS (Near-InfraRed Spectroscopy), признана в качестве чувствительного метода оценки перфузии и метаболизма в органах. Поддержание адекватной тканевой перфузии и доставки кислорода к органам является одной из основных задач ведения пациентов в критическом состоянии. Системы мониторинга для обнаружения изменений в регионарном кровотоке или выявления дисбаланса между доставкой и использованием кислорода в настоящий момент остаются неоптимальными и требуют доработки.
Одним из недостатков метода NIRS является то, что он не измеряет оксигенацию тканей pO2, но предоставляет информацию об оксигенации сосудов (Одним из недостатков метода NIRS является то, что он не измеряет оксигенацию тканей pO2, но предоставляет информацию о оксигенации сосудов (SrO2), которая является результатом баланса между доставкой и потреблением кислорода. Тем не менее, SrO2 обеспечивает подход к общей оксигенации и общему кровотоку в исследуемой ткани, который, в случае печени, уже был описан доктором Эль-Десоки в двух экспериментальных исследованиях на животных.
Несмотря на значительный прогресс в области трансплантации печени, потери трансплантатов и пациентов все еще происходят в результате посттрансплантационных осложнений. Тяжелейшими прогностически являются такие осложнения, как окклюзия печеночной артерии, тромбоз воротной вены, первично нефункционриующий трансплантат и острое отторжение трансплантата. Нарушение микроциркуляции трансплантата печени и гипоксия тканей являются частой патологией при всех этих осложнениях с возможной потерей трансплантата без раннего вмешательства в лечение пациента. Раннее выявление этого нарушения может снизить общую заболеваемость и смертность при трансплантации печени за счет более раннего начала лечения. Было показано, что измерение оксигенации ткани печени (LSrO2) в значительной степени коррелирует с нарушением микроциркуляции и дисфункцией печени, вызванными ишемией и реперфузионным повреждением.
Полезность NIRS для измерения печеночного кровотока и оксигенации была достаточно продемонстрирована экспериментальными исследованиями Tokuta et al. и El-Desoky, в которых NIRS продемонстрировала свою ценность в обнаружении низкого кровотока и снижении оксигенации печени при пережатии её сосудов при выполнении сложных операций.
В настоящее время активно развивается трансплантация печени. Однако виду высокого хирургического, анестезиологического и анестезиологического рисков данный вид лечения может создавать ряд проблемных ситуаций в посттрансплантационном периоде, такие как острая дисфункция трансплантата или сосудистая ишемия печени, которые ставят под угрозу жизнеспособность органа. Раннее обнаружение любой из вышеописанных патологий трансплантата может ускорить проведение медицинских, хирургических или инвазивных решений, чтобы вовремя спасти трансплантат.
Цель исследования.
Цель исследования состояла в том, чтобы проанализировать полезность LSrO2 для определения любого возможного снижения кровотока печеночного трансплантата и его оксигенации из-за сосудистой обструкции или кровотечения, а также узнать корреляцию LSrO2 с клиническими параметрами, связанными с ишемией, гипоксией органа. Также целью было оценить корреляцию LSrO2 и реперфузионного повреждения или любого другого нарушение функции трансплантата. Авторы также попытались проанализировать любую корреляцию LSrO2 с клиническими данными, изменениями биохимии печени и данными УЗИ.
Методы.
Авторы провели проспективное, одноцентровое и неинтервенционное исследование, которое было одобрено Этическим комитетом университетской больницы Инфанта Кристина, Бадахос, Испания.
Все пациенты были госпитализированы в отделение реанимации и интенсивной терапии (ОРИТ) в течение раннего послеоперационного периода после трансплантации печени и наблюдались там не менее 48 часов.
В исследование были включены 57 взрослых пациентов, перенесших первичную плановую трансплантацию печени. Всем пациентам был пересажен аллотрансплантат печени от умерших доноров. Семь пациентов с индексом массы тела >29,9 были исключены, так как подкожная жировая ткань более 2 см могла ограничивать глубину проникновения NIRS . В итоге в исследование были включены 50 пациентов (41 мужчина, 9 женщин, средний возраст 57,3 года и стандартное отклонение (SD) 8,37). Ни один из пациентов не страдал тяжелыми заболеваниями сердца, легких или кожи.
Методика NIRS и клинические данные.
NIRS — это неинвазивный метод, который позволяет осуществлять непрерывный мониторинг регионального насыщения кислородом (SrO2) тканей.. Измерения в этом исследовании проводились с помощью аппарата INVOS 5100 C (Somanetics, Medtronics, Minneapolis, Minn). Датчики NIRS, используемые в этом исследовании, имели максимальную глубину проникновения примерно 2,5 см. Измерения NIRS проводились медсестрой отделения интенсивной терапии и записывались в электронный файл каждого пациента.
У всех пациентов, перенесших трансплантацию печени, с индексом массы тела <29,9 хирург до операции измерял толщину вышележащих тканей с помощью хирургической линейки. После закрытия раны местоположение аллотрансплантата печени отмечали на коже хирургическим кожным маркером.
По прибытии в отделение интенсивной терапии датчик NIRS был прикреплен к уровню аллотрансплантата печени. Мониторинг NIRS начался сразу после прибытия в ОРИТ. У всех пациентов показатели измерялись в положении лежа на спине.
Измерения LSrO2 постоянно контролировались и сохранялись в течение 24 часов. Через 6 часов после операции выполняли рутинное УЗИ.
Жизненно важные параметры, такие как артериальное давление, частота сердечных сокращений, насыщение кислородом, анализ газов крови, лактат крови, сатурация смешанной венозной крови (SvO2), давление заклинивания легочных капилляров, сердечный индекс (СИ) и диурез регистрировались постоянно. Уровни сывороточного гемоглобина, лактата и биохимический профиль печени — аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), лактатдегидрогеназа, гамма-глутамилтрансфераза (ГГТ) и щелочная фосфатаза (ЩФ) определялись каждые 8 часов в первом послеоперационном периоде в течение первых послеоперационных суток.
Шкалы индекса тяжести состояния, такие как Sequential Organ Failure Assessment (SOFA) и Apache II, также рассчитывались при поступлении в отделение интенсивной терапии, и регистрировалось время холодовой/тепловой ишемии трансплантата.
УЗИ.
УЗИ выполняли в первые и пятые сутки после операции в соответствии с местными стандартами протокола оценки кровотока в аллотрансплантатах печени. Измерения проводились с помощью системы iU22 (Philips, Амстердам, Нидерланды) с датчиком с изогнутой матрицей C5-2. Рассчитывали пульсационный индекс (ПИ) и резистивный индекс (РИ). Пороговое значение ПИ >1,8 использовалось для подтверждения нарушения кровотока. УЗИ выполнялось опытными врачами гепатологами, которые не знали результатов NIRS и не знали о проведении данного эксперимента.
Статистический анализ.
Результаты выражены как медиана. Статистический анализ проводили в программе SPSS (версия 22; SPSS, Чикаго, штат Иллинойс, США). Проведен расчет корреляции между средними измерениями LSrO2 с SOFA, Apache II, временем холодовой и теплой ишемии, уровнями гемоглобина, SvO2, лактатом, АСТ, АЛТ, ЛДГ, ГГТ и МНО. Использовался коэффициент корреляции Пирсона. P < 0,05 был определен как статистически значимый.
Результаты.
Демографические данные представлены на рис. 1.
Во время исследования мы обнаружили несколько серьезных осложнений, не связанных явно с хирургическим вмешательством (Таблица 1). У шестнадцати пациентов наблюдались осложнения. У одного и того же пациента наблюдалось не более 1 тяжёлого осложнения. Все 16 осложнений были успешно пролечены. Семь пациентов из группы кровотечения/анемии были успешно пролечены внутривенным введением витамина К и протромбинового комплекса, но 5 из них потребовали возвращения в операционную для проведения гемостаза.
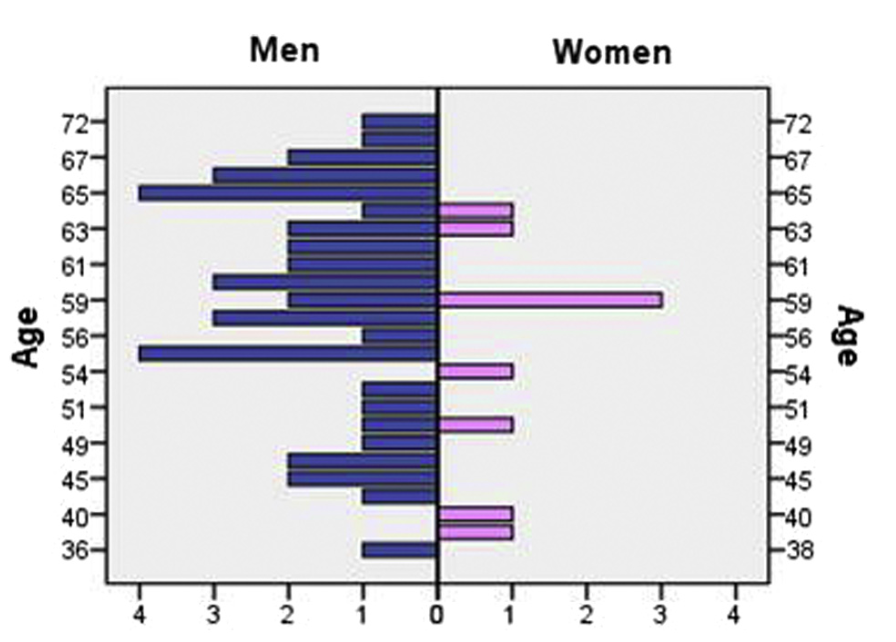
Рисунок 1. Демографические данные. 50 пациентов, 9 женщин и 41 мужчина, возраст 36–72 года; среднее значение 57,3; стандартное отклонение 8,37; медиана — 59 лет.
| Таблица 1. Нежелательные явления, наблюдаемые в исследовании. Все случаи были обнаружены на ранней стадии при помощи NIRS | |||
| Тип осложнения | Особенности | Количество | Исход |
|---|---|---|---|
| Кровотечение/анемия | Трансфузия более трёх доз эр. массы в течение 12 часов | 12 | 5 релапаротомий |
| Сердечная недостаточность | Низкий сердечный выброс | 2 | 1-й случай — кардиогенный шок, 2-й — фибрилляция предсердий |
| Дыхательная недостаточность | Бронхоспазм | 1 | Реинтубация |
| Сепсис | Септический шок | 1 | Смерть пациента |
| Всего осложнений | 16 | ||
В группе пациентов с кровотечением/анемией потери трансплантата не наблюдалось.
Критический побочный эффект наблюдался у 1 пациента без предшествующего кардиологического анамнеза, у которого развился ранний кардиогенный шок из-за синдрома Такоцубо, подтвержденный трансторакальным и чреспищеводным ультразвуковым исследованием сердца и дополнительно подтвержденный вентрикулографическим исследованием. Этот пациент оптимально отреагировал на добутамин и левосимендан, но первоначально потребовалась внутриаортальная контрпульсация с баллонным насосом. У другого пациента развилась острая фибрилляция предсердий, которая разрешилась на фоне электрической кардиоверсии.
Еще у одного пациента развился бронхоспазм, который не получилось купировать медикаментозно; повторная интубация плюс искусственная вентиляция легких потребовались в течение дополнительных 48 часов.
Также, у одного пациента развился рефрактерный септический шок легочного генеза и абдоминальный осложненный перитонит, приведший к полиорганной недостаточности. Эти осложнения явились причиной единственной смерти пациента за время исследования.
Среднее значение LSrO2 у всех пациентов в начале мониторинга составило 74 (стандартное отклонение 5,7) с тенденцией к небольшому прогрессивному увеличению в течение длительного наблюдения, показывая среднее значение 76 (стандартное отклонение 4,1) на 24-м часу мониторинга.
При изучении корреляции были обнаружены релевантные и значимые данные на 3-м часу мониторинга (рис. 2) между LSrO2 и Hb (P < 0,004).
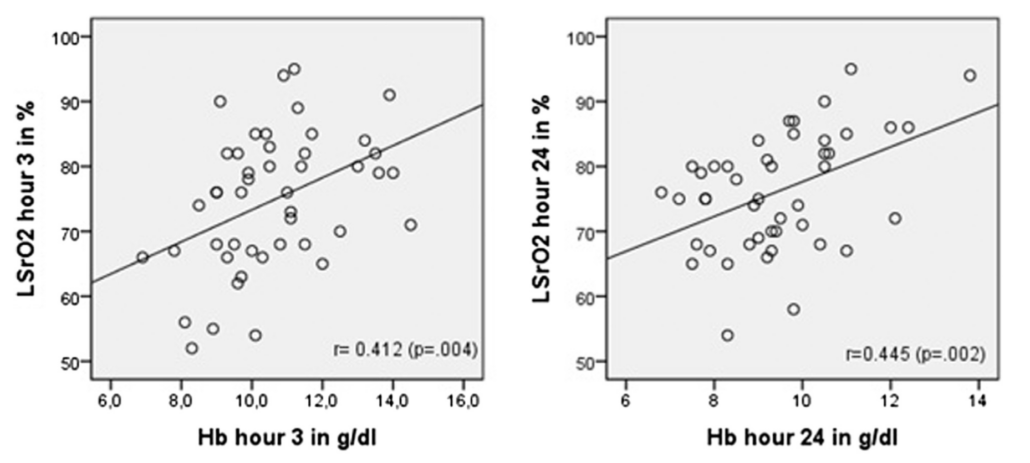
Рисунок 2. Диаграмма и линейная регрессия LSrO2 по сравнению с Hb через 3 и 24 часа. LSrO2 выражен в процентах, а Hb — в г/дл
Также корреляция выявлена между LSrO2 и шкалой Apache II (P < 0,041), но не к шкале SOFA (P < 0,069) (рис. 3).
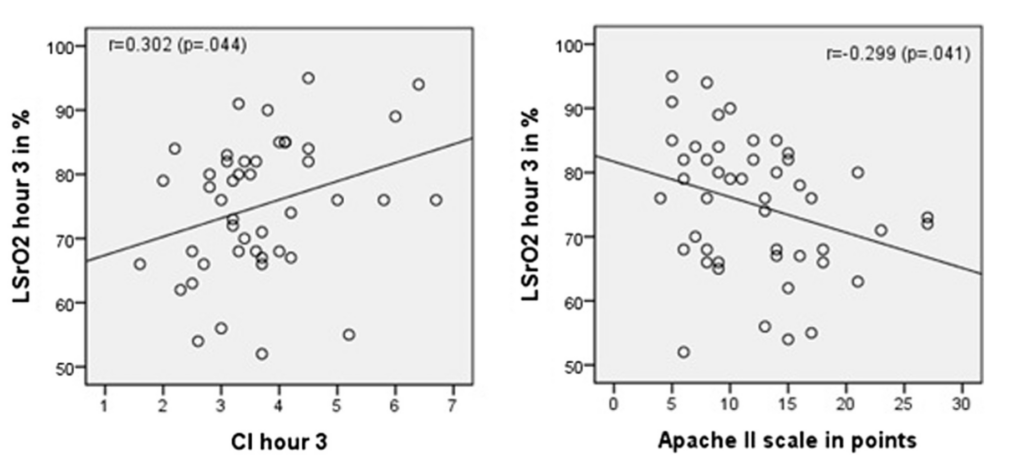
Рисунок 3. Диаграмма и линейная регрессия LSrO2 по сравнению с сердечным индексом и с Apache II. LSRO2 выражается в процентах, а Apache II — в точках шкалы.
Через 24 часа мы также обнаружили значительную корреляцию между LSrO2 и Hb (P < 0,002) (рис. 2). Никакой корреляции с лактатом не наблюдалось ни в один из моментов исследования (P < 0.113; P < 0.293 и P < 0.141 соответственно).
Важно отметить, что ни в начале, ни в конце исследования не наблюдалось корреляции между LSrO2 и биохимией печени (АСТ, АЛТ, ГГТ и ЛДГ).
Наконец, среди гемодинамических параметров обнаружена корреляция между LSrO2 и сердечным индексом на 3-м часу (P < ,044), но не на 8 и 24 часах. Корреляции также не удалось обнаружить между LSrO2 и SvO2 (P < 0. 293).
Данные УЗИ, выраженные как индексы RI и PI, не коррелировали с LSrO2 через 24 часа (P < 0,738 и P < 0,799 соответственно). Мы также не смогли найти какой-либо статистической связи между LSrO2 и временем холодово-тепловой ишемии (P < 0,780 и P < 0,951).
В более исчерпывающем исследовании, посвященном подгруппам, была обнаружена значимая корреляция между холодовой ишемией и МНО в последний период (24 часа) (P<0,016) (рис. 4).
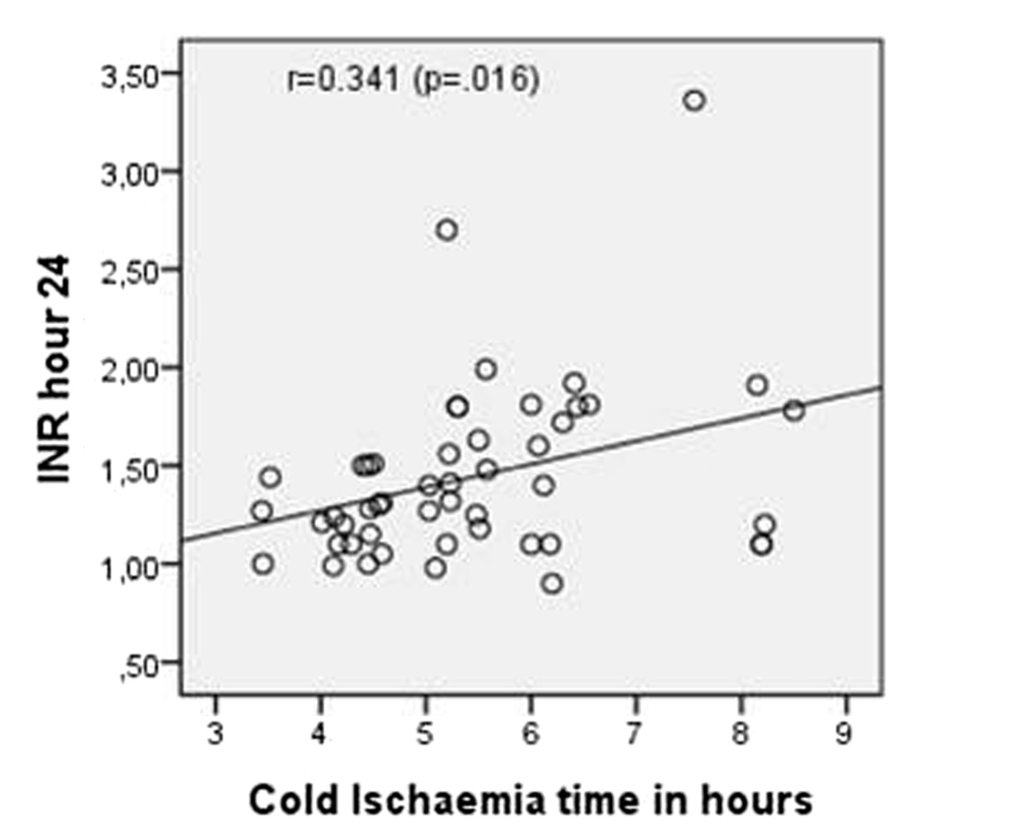
Диаграмма и линейная регрессия МНО по сравнению с холодовой ишемией через 24 часа наблюдения. МНО, выраженное в соотношении, холодовая ишемия в часах.
Значимая статистическая корреляция также существовала между МНО при поступлении (3-й час) и всеми параметрами биохимии печени (3-й час и 24-й час) (таблица 4).
Более подробный анализ данных представлен в таблицах 2 и 3.

Таблица 2. Корреляция между LSrO2 с различными данными: клиническими, биохимическими и УЗИ. Звездочкой обозначены статистически достоверные корреляции.
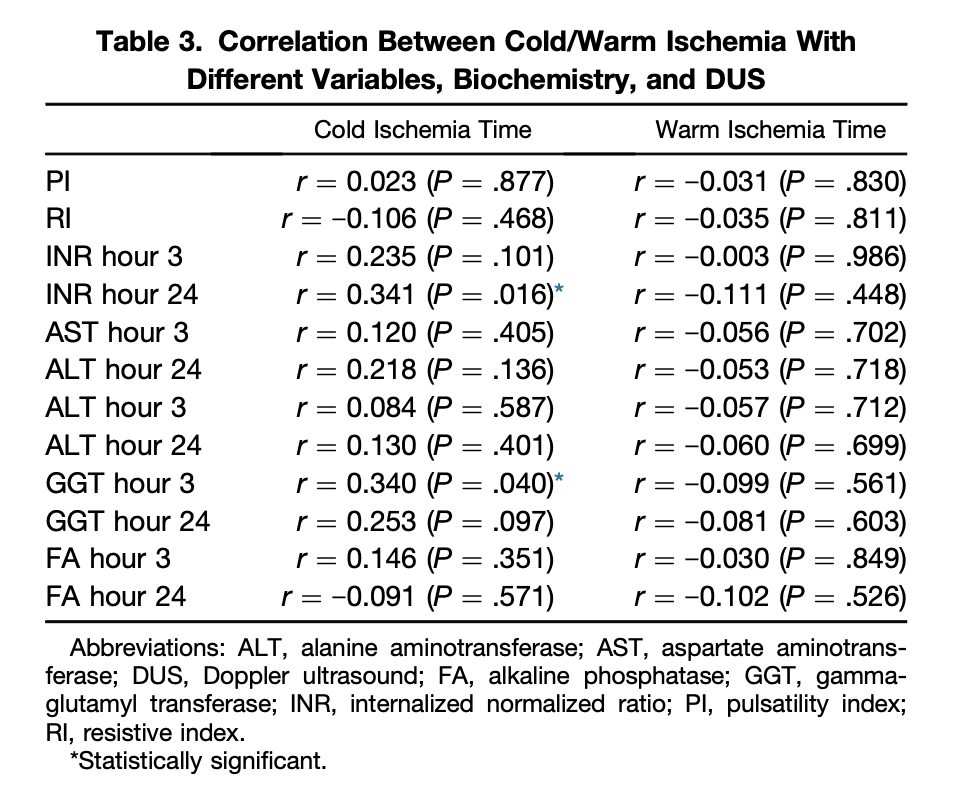
Таблица 3. Корреляция между холодовой/тепловой ишемией с различными переменными, биохимическими показателями и УЗИ. Звездочкой обозначены статистически достоверные корреляции.
Обсуждение результатов.
Любая клиническая ситуация или сценарий, который приводит к снижению кровотока в печени или низкой доставке кислорода в печень, вызовет повреждение печеночной ткани, что приведет к метаболическим нарушениям трансплантата и, возможно, отсроченной функции трансплантата, отторжению и билиарным или сосудистым осложнениям. Обнаружение значимой корреляции между LSrO2 и Apache II при поступлении можно объяснить влиянием исходной степени тяжести пациента, а также тяжестью перенесенного хирургического вмешательства.
Печень — это орган, который активно взаимодействуюет со всеми системами организма, поэтому пациент, которому пересаживают печень, сталкивается с огромным набором физиологических изменений. Во время и в ближайшем послеоперационном периоде печень подвергается воздействию широкого спектра потенциально повреждающих факторов, включая гипотензию, гипоксию, ишемию и гепатотоксические препараты; кроме того, донорские факторы (стеатоз печени, применение вазоактивных препаратов, гемодинамические изменения), хирургические аспекты (интра- или послеоперационное кровотечение, сосудистые или билиарные осложнения) или иммунные реакции (отторжение) могут привести к тяжелым последствиям для организма. Таким образом, послеоперационный результат у каждого пациента сильно различается в зависимости от предоперационного состояния пациента, качества донорского органа и сложности операции.
Насколько нам известно, это одно из крупнейших исследований LSrO2 при помощи NIRS у взрослых пациентов с трансплантацией печени.
Чрезвычайно важно, что LSrO2 может выявить проблемы на ранней стадии у всех пациентов с состояниями низкого кровотока и низкой оксигенации, показывая явное снижение по данным NIRS по крайней мере на 10%, которое сохранялось до выздоровления или купирования патогенного состояния.
Данное исследование показывает, что LSrO2 выявляет раннее значительное снижение кровотока или оксигенации печени, например при снижении сердечного индекса или при массивных кровотечениях.
Отсутствие значимой корреляции между LSrO2 и уровнями лактата в случае трансплантации печени имеет разумное объяснение, основанное на клиническом выражении, согласно которому тяжелые заболевания печени обычно сопровождаются более высокими уровнями лактата из-за нарушенного метаболического состояния нативной печени, которое не может правильно использовать метаболические пути для очистки от лактата. Кроме того, поскольку 5% лактата метаболизируется в почках, острая почечная недостаточность в условиях критического состояния может усугубить гиперлактатемию. В то время как здоровая печень имеет огромный функциональный резерв метаболизма лактата, клиренс лактата нарушается при хронических заболеваниях печени из-за уменьшения функциональной массы гепатоцитов. Это является причиной того, что повышение уровня лактата во время раннего посттрансплантационных периода у многих пациентов не связано с низкой перфузией или гипоксическими состояниями, и это является причиной отсутствия корреляции между LSrO2 и уровнями лактата.
Наблюдение отсутствия корреляции между LSrO2 и биохимией печени в раннем послеоперационном периоде трансплантации печени может быть объяснено тем, что в начальный послеоперационный период уровень печеночных биомаркеров неадекватен ввиду того, что трансплантат перенес холодившую и тепловую ишемию, а также реперфузию.
Объяснение положительной корреляции на 24-м часу между временем холодовой ишемии и МНО, а также с уровнем ГГТ может быть ввиду того, что более длительное время ишемии приводит к изменению факторов, зависящих от витамина К, и повреждения клеток печени, где оба действия выражаются в пролонгированном МНО и повышении ГГТ.
Отсутствие какой-либо статистической корреляции между LSrO2 и УЗИ-картиной должно быть связано с очень ранним проведением исследования УЗИ, которое, возможно, не может отражать основные сосудистые проблемы, которые могут проявиться позже. Тем не менее, мы должны иметь в виду, что в данном исследовании ни у одного пациента не было выявлено венозных или артериальных тромбозов, поэтому основные тяжелые сосудистые осложнения выявить не удалось.
Данное исследование имеет несколько ограничений по количеству пациентов, а также по отсутствию пациентов с серьезными артериальными и венозными осложнениями, которые, к счастью, не являются частыми осложнениями, но могут реально поставить под угрозу жизнеспособность трансплантата и могли быть изучены с помощью LSrO2.
Выводы.
NIRS и измерение LSrO2 — это новый инструмент мониторинга, который дает ценную информацию о печеночном кровотоке и оксигенации сразу после трансплантации печени. Его можно легко практиковать и интерпретировать, но все же рекомендуется провести дополнительные исследования для его использования.
Источник: Transplantation Proceedings.





Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!