Билиарная атрезия. Показания к трансплантации печени.
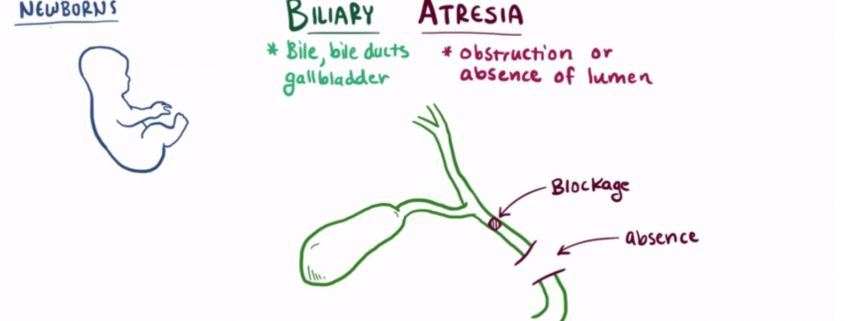
Билиарная атрезия — это прогрессирующее фибро-облитерирующее заболевание внутрипеченочных и внепеченочных желчных протоков у новорожденных детей. Билиарная атрезия повсеместно, её заболеваемость составляет 1 случай на 10 000 — 18 000 новорожденных.
У большинства детей с атрезией желчевыводящих протоков, в конечном счёте, развивается цирроз печени, и им требуется трансплантация печени.
В данной статье будут рассмотрены показания к трансплантации печени при билиарной атрезии, а также подготовка к трансплантации печени детей с билиарной атрезией.
Билиарная атрезия. Причины возникновения.
Содержание статьи:
Причины и патогенез атрезия желчных ходов до конца не ясны. В большинстве случаев при атрезии желчные протоки сформированы, однако их проходимость нарушена вследствие облитерации или прогрессирующей деструкции. Чаще всего причиной обстуктивной холангиопатии становятся внутриутробные инфекции (герпес, краснуха, цитомегалия и др.) или неонатальный гепатит. Воспалительный процесс вызывает повреждение гепатоцитов, эндотелия желчных ходов с последующим внутриклеточным холестазом и фиброзом желчных ходов. Реже атрезия желчных ходов связана с ишемией протоков. В этих случаях атрезия желчных ходов не обязательно будет носить врожденный характер, а может развиваться в перинатальном периоде вследствие прогрессирующего воспалительного процесса.
Истинная атрезия желчных ходов выявляется реже и связана с нарушением первичной закладки желчных путей в эмбриональном периоде. При этом в случае нарушения закладки печеночного дивертикула или канализации дистальных отделов желчевыводящей системы развивается атрезия внутрипеченочных желчных ходов, а при нарушении формирования проксимальных отделов желчевыводящей системы — атрезия внепеченочных желчных протоков. Желчный пузырь может являться единственным звеном наружных желчевыводящих путей или отсутствовать полностью.
Примерно у 20% детей атрезия желчных ходов сочетается с другими аномалиями развития: врожденными пороками сердца, незавершенным поворотом кишечника, аспленией или полиспленией.
Показания к трансплантации печени при билиарной атрезии.
- Неудачная портоэнтеростомия по Касаи;
- Отсутствие желчеотведения;
- Позднее развитие цирроза, несмотря на хороший отток желчи;
- Поздняя диагностика билиарной атрезии;
- Невозможность адекватной нутритивной поддержки;
- Невыполнение требований, требующих агрессивной поддержки питания;
- Метаболическая болезнь кости, приводящая к переломам;
- Рецидивирующий холангит, несмотря на соответствующую антибактериальную терапию;
- Мультирезистентные бактериальные штаммы;
- Жизнеугрожающий сепсис;
- Периодические госпитализации, ухудшающие качество жизни;
- Осложнения синдрома портальной гипертензии;
- Кровотечения из варикозно расширенных вен пищевода;
- Напряженный асцит и эпизоды спонтанных бактериальных перитонитов;
- Злокачественная тромбоцитопения;
- Выраженный зуд;
- Легочные сосудистые расстройства;
- Гепатопульмональный синдром;
- Порто-пульмональная гипертензия;
- Гепаторенальный синдром;
- Злокачественные новообразования печени;
- Гепаитоциллюлярная карцинома;
- Холангиокарцинома.
Неудачная портоэнтеростомия по Касаи.
Понятие порогового возраста, после которого портоэнтеростомия по Касаи (ПЭС) неэффективно, остаётся дискутабельным. Считается, что пациенты с «поздно выполненной ПЭС», это те пациенты, которым ПЭС выполнили в сроки более 90 дней с момента рождения.
Мировые исследования показали, что у таких пациентов двухлетняя выживаемость составляет до 42%, 23-45% через 4-5 лет, 15-40% после 10 лет.
Ни фиброз, выявленный морфологически, ни узловатый вид печени во время ПЭС достоверно не предсказывают результат после операции.
Однако ПЭС у младенцев с циррозом и асцитом может ускорить печеночную декомпенсацию. В нескольких исследованиях было показано, что пациенты с предшествующей ПЭС подвергаются повышенному риску перфорации кишечника и билиарных осложнений после трансплантации печени.
Во многих трансплантационных центрах в мире считается целесообразным выполнить трансплантацию печени, нежели портоэнтеростомию по Касаи.
Билиарная атрезия. Портоэнтеростомия по Касаи не рекомендуется к выполнению у детей с билиарной атрезией во многих трансплантационных центрах.
Нутритивные нарушения.
У детей с нарушенным желчеоттоком (в том числе после ПЭС) будет постепенно развиваться значительная мальабсорбция, белково-энергетическая недостаточность, и, как следствие, задержка развития.
Дети с нормализацией желчеоттока после ПЭС, также будут страдать от этих последствий, хоть и несколько позже. Помимо всего прочего, у таких пациентов наблюдаются биохимическая и клиническая недостаточность жирорастворимых витаминов, железа и цинка являются общими и требуют агрессивной коррекции и регулярного мониторинга.
Метаболические нарушения в костях скелета, приводящие к рецидивирующим переломам, также могут развиваться по мере прогрессирования заболевания печени, даже без дефицита витамина D или кальция.
Также, агрессивная нутритивная поддержка (включая назогастральные кормления или парентеральное питание) является показанием к трансплантации печени.
Бактериальный холангит.
От 40% до 80% пациентов после ПЭС испытывают по крайней мере 1 эпизод бактериального холангита до достижения 2-летнего возраста, а у 25% пациентов случаются частые рецидивирующие холангиты. Послеоперационный холангит ассоциируется с снижением 1- , 3- и 5-летней выживаемости по сравнению с детьми без холангита (92%, 76% и 76% против 80%, 51% и 23% соответственно).
Кроме того, рецидивирующий холангит дает 3-кратное повышение риска нарушения желчеоттока после ПЭС, которое приводит к билиарному циррозу.
Также показаниями к трансплантации печени являются те случаи, когда у ребенка развивается рецидивирующий холангит, несмотря на агрессивную антибактериальную терапию, высеваются полирезистентные бактериальные штаммы, развивается сепсиса. Также снижение качества жизни из-за частых госпитализаций по поводу холангитов относят к показаниям к трансплантации печени.
Портальная гипертензия.
Не смотря на то, что у 60% младенцев с билиарной атрезией восстанавливается желчеотток после ПЭС, печеночный фиброз постепенно прогрессирует. Из-за этого у большинства детей развивается портальная гипертензия.
Проявления портальной гипертензии:
- Спленомегалия;
- Асцит;
- Варикозное расширение вен желудка с риском желудочно-кишечных кровотечений;
- Панцитопения.
Проявления портальной гипертензии связаны со значительной заболеваемостью и смертностью. Пациенты с портальной гипертензией требуют регулярного наблюдения.
Зуд.
По данным мировой литературы, чаще сообщается о детях с синдромом Аладжиля и прогрессирующем семейном внутрипеченочном холестазом, что у них чаще бывает зуд. Однако холестаз-индуцированный зуд может возникать и при билиарной атрезии. У некоторых пациентов зуд достаточно значительно выражен, и сильно ухудшает качество жизни как ребенка, так и его родителей.
В этих случаях необходимо подтвердить, что диагноз билиарной атрезии правильно установлен, а также, что были исключены другие медицинские причины зуда (например, атопия, педикулез или крапивница). Трансплантация печени показана для пациентов с трудноизлечимым зудом, который нарушает сон, или нормальную деятельность, не смотря на адекватную терапию.
Гепатопульмональный синдром и портопульмональная гипертензия.
Гепатопульмональный синдром (ГПС) и портопульмональная гипертензия (ППГ) могут возникать вследствие билиарной атрезии и являются показаниями к трансплантации печени из-за высокой смертности без проведения трансплантации печени. ГПС характеризуется артериальной гипоксемией, вызванной расширением внутрилегочных сосудов у пациентов с синдромом портальной гипертензии или врожденными портосистемными шунтами.
Гипоксия, повышенная утомляемость и вялость являются основными клиническими проявлениями. ГПС Развивается у 3-20% детей с циррозом печени.
Диагноз ГПС устанавливается на основании сцинтиграфии (определяются лёгочные шунты, сформировавшиеся на фоне портальной гипертензии), а также на основании ЭХО-кардиографии.
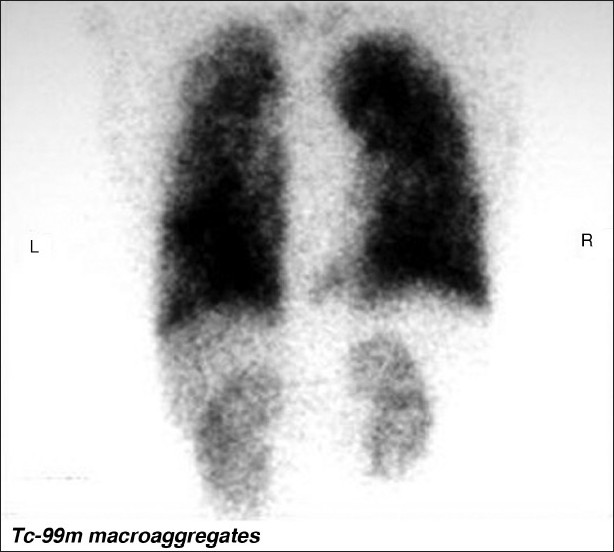
Билиарная атрезия. Сцинтиграфия лёгких при гепатопульмональном синдроме.
Эффективной терапии, помимо трансплантации печени, для ГПС и ППГ не существует. В некоторых случаях применяют инсуффляцию увлажнённого кислорода, что может увеличить парциальное давление кислорода в периферической крови. Тяжелая гипоксемия (PaO2 <45-50 мм рт. ст.) создаёт дополнительные сложности у детей с циррозом печени после трансплантации печени (сложности с экстубацией в раннем послеоперационном периоде).
Во многих трансплантационных центрах при ГПС и ППС измеряют среднее давление лёгочной артерии (mPAP), и если оно выше >50 мм.рт.ст., это является противопоказанием к трансплантации печени из-за высокой интраоперационной и послеоперационной смертности.
Таким образом, ГПС и ППС являются показаниями к трансплантации печени при билиарной атрезии, но тяжесть и темпы прогрессирования этих расстройств диктуют необходимость срочной оценки показаний к трансплантации.
Гепаторенальный синдром.
Гепаторенальный синдром (ГРС) является редким осложнением на терминальных стадиях болезней печени, при котором развивается острая почечная недостаточность. Особенность этого синдрома заключается в том, что он развивается несмотря на интактные почки, ввиду уменьшения почечного кровотока. Это тяжелое осложнения купируется после трансплантации печени и функция почек восстанавливается. Поэтому ГРС является показанием к трансплантации печени у детей с билиарной атрезией.
Злокачественные опухоли печени.
Озлокачествление является признанным осложнением хронических заболеваний печени. В редких случаях (менее 1%) у детей первых месяцев жизни на фоне билиарной атрезии может развиваться гепатоцеллюлярная карцинома. Холангиокарцинома встречается ещё реже.
При повышенный уровня альфа-фетопротеина или выявления подозрительных очагов при УЗИ печени, необходимо дополнительная визуализация в виде компьютерной томографии с внутривенным болюсным контрастированием для подтверждения диагноза и оценки метастазирования.
Полное хирургическое удаление опухоли — единственный радикальный вариант лечения, хотя, по литературным данным, химиотерапия может быть более эффективной у детей, чем у взрослых. Миланские критерии могут быть неприменимы для детей, и успешные результаты трансплантации печени были достигнуты даже у детей, которые не соответствовали более «мягким» критериям Калифорнийского университета Сан-Франциско (одиночная опухоль <6,5 см или максимум 3 опухоли, причём каждая в диаметре не более 4,5 см, и общим размером опухолевых узлов <8 см) или критерий «до 7» (отсутствие сосудистой инвазии, количество узлов плюс максимальный размер самого крупного узла ≤7 см). Поэтому решение проводит трансплантацию печени должно быть индивидуализировано для каждого ребенка.
Трансплантацию следует рассматривать в тех случаях, когда отсутствуют доказательства внепеченочного распространения опухоли или сосудистой инвазии, независимо от размера опухоли или количества опухолевых узлов.
Билиарная атрезия. Подготовка детей к трансплантации печени.
Оптимальная подготовка к трансплантации печени требует наличия в клинике многопрофильной команды с опытом работы с билиарной атрезией и осложнениями хронических заболеваний печени. команда специалистов состоит из следующих специалистов: педиатр, хирург, реаниматолог, диетолог, социальный работник,детский психолог, фармаколог, медсестры.
Ряд важных вопросов должен быть рассмотрен для каждого кандидата на трансплантацию печени с билиарной атрезией.
Особенности нутритивной поддержки детей с билиарной атрезией.
Одним из ключевых предикторов успешной трансплантации печени у пациентов с билиарной атрезией является адекватная нутритивная поддержка. Оценка нутритивного статуса ребёнка должна быть частью стандартного протокола подготовки к трансплантации печени с момента установления диагноза билиарной атрезии. Регулярная оценка нутритивного статуса диктует агрессивность, с которой осуществляется поддержка питания детей (см. таблицу № 1).
Увеличение массы тела ребенка может дать ложное представление о адекватном развитии ребёнка, поскольку гепатоспленомегалия, асцит и отеки могут давать ложное представление о качественном составе веса.
Таблица 1. Нутритивная поддержка детей с билиарной атрезией.
| Питательные вещества. | Показания. | Назначения и дозировки. | Побочные эффекты/Токсичность/Особенности. |
|---|---|---|---|
| See Feranchak, Suchy, Sokol (2014). | |||
| Макронутриенты. | |||
| Энергия. | Данные антропометрии, толщина трицепса и толщина подколенной складки, измерения веса и роста в динамике, косвенная калориметрия, мальабсорбция жиров. | Целевая калорийность: 125% — 140% от расчётного суточного каллоража в расчете на вес на рост. Высококалорийное детское питание. Концентрат детской смеси с добавлением глюкозных полимеров (энергетическая ценность должна быть примерно 100,5-113 кДж / 30 мл). При необходимости назначаются дополнительные ночные или непрерывные ежедневные назогастральные капельные кормления, парентеральное питание. | Большие затраты на питание, аспирационная пневмония. |
| Незаменимые жирные кислоты. | Дефицит жирных кислот | Назначение липидных эмульсий или специального питания, в том числе парентерального. | |
| Белки. | Задержка мышечного развитие, сывороточный альбумин менее 35 г/л. | Потребление белков 2-4 г / кг / день у младенцев. Потребление белка 2 г / кг / день при печеночной энцефалопатии. | |
| Жирорастворимые витамины. | |||
| Витамин A. | Дефицит витамина А: ретинол: ретинолсвязывающий белковый молярный коэффициент <0,8 или сывороточный ретинол <20 мкг / дл; цитологическое исследование конъюнктивы; ксероз, пятна Бито. | 5000-25,0000 ед/день препарата витамина А перорально смешиваемой с водой, в/м инъекции витамина А. | Гепатотоксичность, костные поражения. |
| Витамин D. | Дефицит витамина D: 25-OH-D <14 нг / мл (недостаточность <30 нг / мл), рахит, остеомаляция. | Витамин D3, до 500-1000 МЕ / кг / день или 25-OHD, 3-5 мкг / кг / день или 1,25-OH2-D, 0,05-0,2 мкг / кг / день. | Гиперкальциемия, нефрокальциноз. |
| Витамин E. | Дефицит витамина Е: витамин Е: общее соотношение липидов <0,6 мг / г (возраст <1 года) и <0,8 мг / г (возраст> 1 года). | α-токоферол (ацетат), 25-200 МЕ/кг/день, токоферол — 15-25 МЕ/кг/день. | Коагулопатия, вызванная дефицитом витамина К, диарея. |
| Витамин K. | Дефицит витамина K: длительное протромбиновое время, увеличение МНО. | назначение препаратов витамина К (Менадион) 4 мг/сут. | |
| Водо-растворимые витамины | Необходимо предотвратить дефицит водорастворимых витаминов. | Токсичность жирорастворимых витаминов. | |
| Минералы и микроэлементы | |||
| Кальций. | Дефицит кальция из-за стеатореи, несмотря на скорректированный статус витамина D | 25-100 мг /кг /день до 800-1200 мг/сут. | Гиперкальциемия, гиперкальциурия. |
| Фосфор. | Низкий сывороточный фосфор, несмотря на коррекцию концентрации витамина D и кальция | 25-50 мг/кг/ день до 500 мг/сут. | Желудочно-кишечная непереносимость. |
| Магний. | Дефицит магния: сывороточный Mg <1,8 мг / дл | Оксид магния, 1-2 мЭкв/кг/день перорально или 50% раствор MgSO 40,3-0,5 мЭкв/кг в течение 3 часов (максимум, 3-6 мг-экв). | Угнетение дыхания, кома. |
| Цинк. | Дефицит цинка: цинк плазмы крови <60 мкг / дл. | Раствор цинкаSO4 (10 мг цинка/мл) 1 мг/кг/день перорально в течение 2-3 месяцев. | Снижение кишечной абсорбция меди и железа. |
| Селен. | Дефицит селена: селен плазмы крови <40 мкг / дл | 1-2 мкг / кг / день орального селенита натрия или 1-2 мкг/кг / день селена в парентеральном питательном растворе. | Кожные изменения (кожные высыпания, изменения ногтей, выпадение волос), диспепсия, диарея, анорексия |
| Железо. | Дефицит железа:
↓ сывороточного железа, ↑ железосвязывающей способности сыворотки, индекс насыщения железом <16% |
Препараты железа 5-6 мг/кг/день. | Окрашивание зубов, геморрагический гастроэнтерит . Передозировка: метаболический ацидоз, кома, печеночная недостаточность. |
Особенности нутритивной поддержки детей с билиарной атрезией.
При наличии холестаза и цирроза цель потребления энергии должна составлять 125 до 140% от рекомендуемых энергетических потребностей, основанных на идеальной массе тела. Дополнительные калории могут потребоваться для обеспечения роста ребёнка, если присутствует значительный дефицит по массы тела, как указано в таблице 1.
Однако, как показывает практика, сложно обеспечить достаточный прирост массы тела ребёнка при наличии тяжелого холестаза. Таким образом, предпочтительными являются детские смеси, содержащие значительное количество специальные масла, абсорбция которых в меньшей степени зависит от желчных кислот, и в то же время содержат адекватное количество незаменимых жирных кислоты (триглицеридов с длинной цепью). Потребление белка должно сохраняться в достаточном объёме (не менее 2-4 г / кг / день) и не должно быть ограничено из-за наличия цирроза печени.
Зондовое и парентеральное питание.
Хотя пероральное кормление ребёнка остаётся предпочтительным, у детей с выраженным дефицитом массы тела и с невозможностью адекватного перорального кормления имеются показания для зондового или парентерального питания
Для зондового кормления рекомендуется использовать мягкие назогастральные трубки, которые снижают риск аспирации и травматизации варикозных вен пищевода.
Также в некоторых случаях требуется назначения парентерального внутривенного непрерывного питания через постоянный центральный венозный катетер (в дополнении к пероральному или назогастральному кормлению.
Мальабсорбция витаминов и микроэлементов.
Кишечная абсорбция витаминов и микроэлементов сильно нарушена у пациентов с билиарной атрезией ввиду того, что желчь не попадает в просвет кишечника. Необходимо регулярно проводить оценку дефицита витаминов и микроэлементов с адекватной коррекцией и оценкой побочных эффектов (см. таблицу 1).
Медикаментозное лечение при подготовке к трансплантации печени.
Медикаментозная поддержка пациентов с билиарной атрезией крайне важна. Ниже будет представлена посиндромная лекарственная терапия различных состояний, которые могут развиваться при билиарной атрезии.
Таблица 2. Медикаментозное лечение пациентов с билиарной атрезией.
| Препарат | Показания | Дозировка | Побочные эффекты |
|---|---|---|---|
| See Feranchak, Suchy, and Sokol (2014). | |||
| Урсодезоксихолевая кислота. | Холестаз, зуд, гиперхолестеринемия. | 15-20 мг/кг/день. | Диарея, усиление зуда. |
| Смолы, связывающие желчные кислоты (холестирамин, колестипол, козезевелам). | Ксантома, зуд, гиперхолестеринемия. | 250-500 мг/кг/день (холестирамин, колестипол). | Запоры, гиперхлоремический ацидоз, связывание лекарственных средств, стеаторея, кишечная непроходимость. |
| Налтрексон. | Зуд. | 1-2 мг/кг/день. | Тошнота, головная боль, реакция отмены опиоидов, возможная гепатотоксичность. |
| Фенобарбитал. | Зуд, гиперхолестеринемия | 3-10 мг/кг/день. | Сонливость, нарушение поведения, нарушение метаболизма витамина D. |
| Рифампицин. | Зуд. | 10 мг/кг/день. | Гепатотоксичность, гемолитическая анемия, почечная недостаточность |
| Антигистаминные препараты. | Зуд. | Димедрол 5 мг/кг/день или гидроксизин 2 мг/кг/день. | Сонливость. |
| Облучение ультрафиолетовыми лучами | Зуд. | Ожоги кожи. | |
| Триметоприм/сульфаметоксазол | Профилактика холангитов. | 2-5 мг/кг/день. TMP | Реакция гиперчувствительности, выделение неконъюгированного билирубина из альбумина, угнетение костного мозга, гепатотоксичность. |
| Фуросемид | Асцит, отёки | От 1 мг/кг/ на внутривенное введение. | Гипонатриемия, гипокалиемия, дегидратация, реакция гиперчувствительности, нарушения слуха, угнетение костного мозга |
| Спиринолактон | Асцит | 2-6 мг/кг/день. | Гипернатриемия, гиперкалиемия, дегидратация гинекомастия, реакция гиперчувствительности |
| Октреотид | Кровотечения из варикозных вен | 1-5 наног/кг/час. | Гипотония, угнетение костного мозга |
| Альбумин | Асцит | 1 г/кг при инфузия 20%-25% раствора альбумина. | Перегрузка жидкостью. |
Билиарная атрезия. Особенности лечения синдрома портальной гипертензии.
Проявления синдрома портальной гипертензии часто требуют медикаментозной или иного медицинского вмешательства. Наиболее частыми жизнеугрожающими проявлениями являются:
- Спленомегалия -> гиперспленизм;
- Асцит;
- Варикозное расширение вен желудка с риском желудочно-кишечных кровотечений.
Кровотечения из варикозно расширенных вен пищевода.
До 90% детей с билиарной атрезией имеют варикозно расширенные вены пищевода при эндоскопическом обследовании, а у ~ 30% случается по крайней мере 1 эпизод кровотечения из варикозно расширенных вен.
Последний консенсус по симпозиуму Baveno VI гласит, что скрининговая эзофагогастродуоденоскопия не рекомендуется всем детям с циррозом. Существует множество аргументов против проведения эндоскопии у пациентов с билиарной атрезией, у которых никогда не было кровотечений из варикозных вен. Во-первых, ~50% детей с билиарной атрезией будут нуждаться в трансплантации печени в первые 2 года жизни, таким образом, после трансплантации проблема с варикозным расширением вен пищевода будет решена. Во вторых, даже при выполненной эндоскопии и последующей эндоскопической коррекции (лигировании вен пищевода) есть высокий риск рецидивов и повторных кровотечений. В-третьих, регулярная ЭГДС влечет за собой риск травматизации варикозно расширенных вен пищевода.
Лечение острого варикозного кровотечения включает в себя трансфузию плазмы и эритроцитарной массы, аналогов соматостатина (например, октреотида), эндоскопическую остановку кровотечения, а также, баллонную тампонады или , реже, портосистемное шунтирование. Коагулопатию с дефицитом витамина K следует лечить с помощью препаратов менадиона. Кроме того, следует назначать антибактериальную терапию ввиду высокого риска потенциально фатальных инфекционных осложнений у пациентов с циррозом и, одновременно, желудочно-кишечным кровотечением.
Октреотид, вызывает вазоконстрикцию с уменьшением портального давления, позволяет контролировать варикозное кровотечение и гемодинамическую стабилизацию. Это позволяет выиграть время и подготовить пациента к эндоскопическому гемостазу или баллонной тампонаде. Октреотид применяется в течение 2-5 дней после состоявшегося варикозного кровотечения.
Баллонная тампонада вен пищевода или портосистемное шунтирование применяется в случае тяжёлого рефрактерного варикозного кровотечения. Баллонная тампонада (с использованием зонда Блекмора) обеспечивает хороший гемостаз путем прямого сжатия варикозных вен пищевода и очень успешно останавливает кровотечение. Однако рецидив кровотечения в течение 24 часов после сдувания баллона происходит у ~ 50% пациентов при отсутствии консервативного лечения, включающего гемостатическую терапию (плазма крови, этамзилат, транексамовая кислота, препараты витамина К).
Трансъюгулярный внутрипеченочный портосистемный шунт (TIPS) или, реже, хирургические портосистемные шунты (портокавальные или дистальные спленоренальные шунты) могут потребоваться для лечения рефрактерного варикозного кровотечения у пациентов с билиарной атрезией.
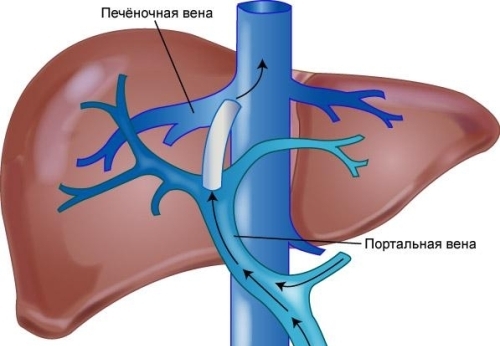
Порто-системный шунт (TIPS)
Тромбоцитопения.
У пациентов с билиарной атрезией наиболее распространенным проявлением гиперспленизма является тромбоцитопения. Нейтропения обычно не имеет последствий. Трансфузии тромбоцитов следует резервировать для тяжелого варикозного кровотечения или клинически значимого кровотечения из других источников при значительном тромбоцитопении (<20-60 × 10^9 / л).
При рецидивирующих кровотечениях, связанных с портальной гипертензией, и сопутствующей тромбоцитопенией, селективная эмболизация селезёночной артерии у пациентов с компенсированным циррозом.
Асцит.
Асцит встречается примерно у одной трети пациентов с синдромом портальной гипертензии. Диуретическая терапия и исключение избыточного потребления натрия (соли) являются основой лечения детей (см. таблицу 2).
При ненапряжённом асците назначают спиринолактон — калийсберегающий диуретик. У пациентов с умеренным или тяжелым асцитом следует использовать спиронолактон и фуросемид наряду с предотвращением употребления продуктов с высоким содержанием натрия.
При асцитах, возникающих на фоне низкого содержания альбумина в плазме крови, наряду с диуретической терапией назначаются инфузии альбумина.
При напряжённых асцитах, которые вызывают дыхательную недостаточность, дополнительно требуется лапароцентез или дренирование брюшной полости. Рекомендуемый объём удаления асцита составляет <200 мл / кг массы тела или <680 мл / час. Если объём сливаемой жидкости больше, требуется назначить дополнительную инфузию альбумина для исключения перераспределительного шока.
Гипонатриемия.
Гипонатриемия (сывороточный натрий <130 мг-экв/л) не редкость у пациентов с билиарной атрезией на фоне асцита. Портальная гипертензия приводит к системной вазодилатации, которая снижает объем артериальной крови. Это вызывает высвобождение аргинин-вазопрессина и антидиуретического гормона, что выводит натрий из кровяного русла. Коррекцию натрия проводят физиологическим раствором или гипертоническим раствором натрия хлорида. Целевые значения натрия — 135-145 мг-экв/л.
Спонтанный бактериальный перитонит.
Спонтанный бактериальный перитонит является серьезным осложнением синдрома портальной гипертензии. Часто он возникает как асцит-перитонит. Источниками инфекции являются стрептококк, а также грамотрицательные бактерии. В таких случаях назначают системные антибиотики.
Лечение бактериального холангита.
Холангит — одно из наиболее распространенных осложнений билиарной атрезии. Холангит стоит подозревать у любого пациента,с повышением температуры тела, рвотой, болью в правом подреберье, осветленным стулом, нарастанием желтухи, ростом аминотрансфераз и ферментов холестаза. У 30% пациентов с вышеперечисленными симптомами будет положительный посев крови (бактериемия). Поэтому, всем пациентом с подозрением на холангит назначают антибактериальную терапию с чувствительностью к грамотрицательным и анаэробным бактериям.
Также отмечено, нет показаний к профилактическому назначению антибиотиков пациентам, перенесших операцию Касаи, у которых не было атак холангита.
Билиарная атрезия. Сроки проведения трансплантации печени.
Не смотря на то, что билиарная атрезия является наиболее распространенным показанием для трансплантации печени, существует недостаточно данных для оптимального выбора времени для трансплантации. Анализ данных UNOS за 2001-2004 гг. Показал, что пациенты с оценкой PELD> 17 имели хорошую выживаемость после трансплантации печени. Однако тяжесть пациентов в соотвтетсвии с критериями PELD не всегда объективна и данные PELD могут не точно отражать истинный риск смертности, поскольку у пациентов, помимо критериев PELD бывают такие осложнения, как портальная гипертензия, варикозные кровотечения, асцитом и т.д. Таким образом, сама билиарная атрезия является показанием к трансплантации печени.
Важным аспектом является «сухой вес ребенка». Понятие «сухой вес» обозначает вес пациента без учёта асцитической жидкости. У детей с малым мышечным весом большой риск слабости дыхательной мускулатуры после проведенных интубации и введения в наркоз во время трансплантации печени. Поэтому, рекомендуемый «сухой вес» пациента должен превышать 6 кг, чтобы рассматривает его на трансплантацию печени.
Также немаловажным фактором, оценивающим оптимальное время для трансплантации печени, является наличие подходящего органа для трансплантации. Так, в случае нехватки посмертных органов, может использоваться прижизненное донорство фрагментов печени для трансплантации детям.
Крайне важно, чтобы семья имела четкое представление о состоянии своего ребенка и осознавали необходимость в трансплантации. Родители часто страдают от чувства неадекватности, вины, стресса, гнева и страха. Установление доверительных отношений между семьей, ребенком и врачами поможет облегчить переживания и принять рациональное решение. Признание и устранение негативных эмоций также может положительно повлиять как на укрепление семьи в трудный период и направить энергию на борьбу с болезнью.
Выводы и заключение.
До тех пор, пока мы не сможем понять истинную патофизиологию билиарной атрезии и, следовательно, разработать адекватное лечебное пособие для её предотвращения, трансплантация печени останется основным методом лечения этого редкого заболевания.
Детям с билиарной атрезией необходима трансплантация печени ввиду развития жизнеугрожающих осложнений.
Нынешняя схема распределения органов не позволяет обеспечить потребность в трансплантации у детей первых лет жизни. Детская смертность в листах ожидания также подчеркивает критическую потребность в новых подходах к расширению пула доноров. Именно поэтому очень важно прижизненная донация фрагментов печени для трансплантации детям.
В Российской Федерации потребность в трансплантации печени детям практически полностью решена за счёт родственного донорства.
Авторский коллектив: Shikha S. Sundaram, Cara L. Mack, Amy G. Feldman, Ronald J. Sokol.
Оригинальная статья была опубликована в журнале «Liver Transplantation» и доступна по ссылке: http://onlinelibrary.wiley.com/doi/10.1002/lt.24640/full
Перевод: Сёмаш Константин Олесьевич.





Ответить
Хотите присоединиться к обсуждению?Не стесняйтесь вносить свой вклад!